
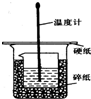
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:分析 (1)中和热测定实验成败的关键是保温工作;
(2)根据量热计的构造来判断该装置的缺少仪器;中和热测定实验成败的关键是保温工作;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)弱电解质电离为吸热过程.
解答 解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(2)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;中和热测定实验成败的关键是保温工作,内外烧杯为一样高,否则,热量散失大;
故答案为:环形玻璃搅拌器;大小烧杯杯口没平;
(3)若用70mL0.50mol•L-1盐酸跟70mL0.55mol•L-1NaOH溶液进行反应,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:不相等;相等;
(4)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替NaOH溶液反应,反应放出的热量偏小,测得的中和热数值会偏小,故答案为:偏小.
点评 本题考查学生有关中和热的测定,题目难度中等,注意理解中和热的概念和测定原理是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H2CO3+OH- | B. | HS-+H2O?S2-+H3O- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源物质 | |
| B. | 海水提溴、海带提碘的过程均不涉及化学变化 | |
| C. | 铝热反应放出大量的热,金属铝做还原剂 | |
| D. | 通过催化重整,可从石油中获取环状烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
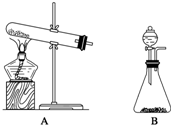 氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:
氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结构简式是CH2CH2 | |
| B. | 使溴的四氯化碳溶液褪色是因为发生了加成反应 | |
| C. | 燃烧没有甲烷剧烈 | |
| D. | 性质比较稳定,不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于冰中的水分子间存在氢键,所以其密度大于液态水 | |
| B. | 可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大 | |
| C. | 分子间氢键和分子内氢键都会使熔沸点升高 | |
| D. | 每一个水分子内平均含有两个氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
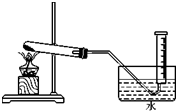 为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2F+的电子式: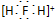 | |
| B. | 铝离子的结构示意图: | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | 丙烷分子的球棍模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com