

| A. | Zn2++2e-═Zn | B. | Cu2++2e-═Cu | C. | Zn-2e-═Zn2+ | D. | 2H++2e-═H2↑ |
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | 漂白粉在空气中久置变质 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 | |
| D. | 浓硫酸可刻蚀石英制艺术品 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu2++2OH-=Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+=CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-=CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-=H2O 2KOH+H2SO4═K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
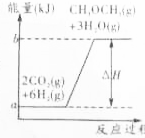 ,工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用进行的,反应器中发生了下列反应:
,工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用进行的,反应器中发生了下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应方程式 | 已知条件 | 预测 |
| A | M(s)═X(g)+Y(s) | △H>0 | 它是非自发反应 |
| B | W(s)+xG(g)═20Q(g) | △H<0,自发反应 | x可能等于1、2、3 |
| C | 4X(g)+5Y(g)═4W(g)+6G(g) | 能自发反应 | △H一定小于0 |
| D | 4M(s)+N(g)+2W(l)═4Q(s) | 常温下,自发进行 | △H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
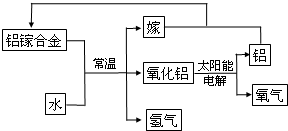 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com