
研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1) 溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
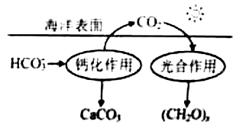
(2)在海洋循环中,通过右图所示的途径固碳。
①写出钙化作用的离子方程式: 。
②同位 素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机 碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。
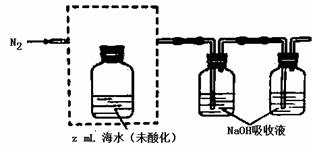
 ②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
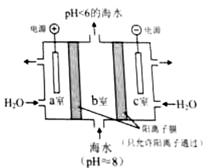
(4)利用右图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO 2的原理: 。
2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。
【答案】 (1)CO2+H2O H2CO3,H2CO3
H2CO3,H2CO3 HCO3-+H+
HCO3-+H+
(2) ①Ca2++ 2HCO3-=== CaCO3↓+ CO2+H2O
①Ca2++ 2HCO3-=== CaCO3↓+ CO2+H2O
②xCO2 2x H218O
(3)①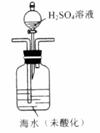
②xy/z
(4)①a室:2H2O-4e-= O2↑+4H+,H+通过阳离子膜进入b室,发生反应:HCO3-+H+= CO2↑+H2O。 ②c室的反应:2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至接近装置入口海水的pH
【解析】 (1)CO2可与水反应生成碳酸,碳酸可微弱电离生成碳酸氢根和氢离子:CO2+H2O H2CO3
H2CO3 HCO3-+H+
HCO3-+H+
(2)①根据反应物是HCO3-,生成物是CaCO3和CO2,易知本题的反应方程式为:
Ca2++ 2HCO3-=== CaCO3↓+ CO2+H2O 。
②根据元素守恒法,及示踪原子的标记可知方程式中的填空为:xCO2 , 2x H218O
(3)①注意酸化的试剂要用硫酸,一定不能用盐酸,因为HCl会挥发出来影响后续的滴定。
②该滴定过程转化的关系式为:
CO2 ~ HCO3-~ HCl
1 1
n(CO2) x mol/L×y×10-3L
解得:n(CO2)=xy×10-3mol 所以:c(CO2)=xy/z mol/L
(4)①海水pH>8,显碱性,需要H+中和降低海水的碱性,a室发生阳极反应:2H2O-4e-= O2↑+4H+, c(OH-)下降,H2O OH-+H+平衡右移,c(H+)增大,H+从a室进入b室,发生反应:HCO3-+H+== CO2+H2O。
OH-+H+平衡右移,c(H+)增大,H+从a室进入b室,发生反应:HCO3-+H+== CO2+H2O。
②c室的反应:2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至接近装置入口海水的pH 。
【考点定位】考查盐类水解、方程式书写、化学实验、化学平衡移动、电解、化学计算等。
【名师点晴】本题以CO2在海洋中的转移和归宿为素材,考查有关化学反应原理知识,难度不大,要求学生掌握弱电解质的电离、化学方程式的书写以及利用守恒观点配平方程式,第(3)小问责考查学生化学实验设计与计算能力,第(4)问利用电化学利用理论从海水中提取CO2,有利于减少环境温室气体含量,体现了化学与环境保护、理论与实际相结合的特点。


科目:高中化学 来源: 题型:
使用哪种试剂,可鉴别在不同试剂瓶内的己烯、甲苯和丙醛
A.银氨溶液和酸性KMnO4的溶液
B.KMnO4溶液和Br2的CCl4溶液
C.银氨溶液和三氯化铁溶液
D.银氨溶液和Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下面有6种有机物,用提供的试剂分别鉴别,将所用试剂及产生的现象的序号填在各个横线上。
| 有机物 | 试剂 | 现象 |
| (1)甲苯 | a.溴水 | A.橙色褪去 |
| (2)苯乙烯 | b.酸性高锰酸钾溶液 | B.紫色褪去 |
| (3)苯酚 | c.浓硝酸 | C.呈蓝色 |
| (4)葡萄糖 | d.碘水 | D.出现砖红色沉淀 |
| (5)淀粉 | e.三氯化铁溶液 | E.呈黄色 |
| (6)蛋白质 | f.新制氢氧化铜悬浊液 | F.呈紫色 |
(1)______________________;
(2)______________________;
(3)______________________;
(4)______________________;
(5)______________________;
(6)______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示:
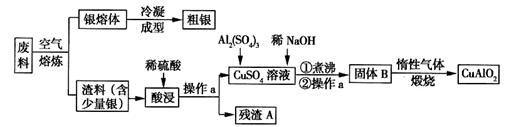
(1)熔炼时被氧化的元素是______,酸浸时反应的离子方程式为_______。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是_______。
(2)操作a是______,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:___CuO+____Al2O3 ______________+________↑。
______________+________↑。
 (3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式________________________。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少为_______L(设空气中氧气的体积分数为0.2)。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式________________________。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少为_______L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+ Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点______________________________。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的_______极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 A.用石墨作阳极,铁作阴极
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。
A.降低了反应的活化能 B.增大了反应的速率
C.降低了反应的焓变 D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(5)题11图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为 ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。

查看答案和解析>>
科目:高中化学 来源: 题型:
1999年,在欧洲一些国家发现饲料被污染,导致畜禽类制品及乳制品不能食用,经测定饲料中含有剧毒物质二恶英,其结构为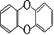 ,已知它的二氯代物有10种,则其六氯代物有( )
,已知它的二氯代物有10种,则其六氯代物有( )
A、15种 B、11种 C、10种 D、5种
查看答案和解析>>
科目:高中化学 来源: 题型:
居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味气体。该气体是-------------------------------------------------------------------------------( )
A 甲烷 B氨气 C 甲醛 D二氧化硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com