
双球连通管中发生2NO2⇌N2O4+Q(Q>0).若同时向两烧杯中分别加入等温、等体积的蒸馏水(左)和0.1mol/L H2O2溶液(右),再向右侧烧杯中加入少量Fe2(SO4)3固体后,则下列有关推断中正确的是( )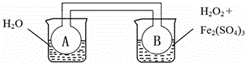
|
| A. | 实验时,A、B中的压强始终相等 |
|
| B. | 若右侧烧杯发生吸热反应,则A中更快达到平衡 |
|
| C. | 若右侧烧杯发生放热反应,则A中颜色较深 |
|
| D. | 能用该装置推断右侧烧杯中反应的热效应 |
| 化学平衡的影响因素. | |
| 专题: | 化学平衡专题. |
| 分析: | A、AB是连通器,实验时AB中压强相同; B、2NO2(红棕色)⇋N2O4(无色),△H<0是放热反应,过氧化氢加入硫酸铁会做催化剂使过氧化氢分解,若右侧烧杯发生吸热反应,则B温度降低反应正向进行,AB中达到平衡; C、2NO2(红棕色)⇋N2O4(无色),△H<0是放热反应,若双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆向反应方向移动,即向生成NO2移动,故B瓶颜色更深; D、依据气体颜色变化分析烧杯中反应的能量变化,若B中气体颜色加深证明是放热反应,变浅证明是吸热反应. |
| 解答: | 解:A、AB是连通器,实验时AB中压强始终相同,故A正确; B、2NO2(红棕色)⇋N2O4(无色),△H<0是放热反应,过氧化氢加入硫酸铁会做催化剂使过氧化氢分解,若右侧烧杯发生吸热反应,则B温度降低反应正向进行,AB中达到相同平衡,故B错误; C、2NO2(红棕色)⇋N2O4(无色),△H<0是放热反应,若双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆向反应方向移动,即向生成NO2移动,故B瓶颜色更深,故C错误; D、若B中气体颜色加深证明是放热反应,变浅证明是吸热反应,可以用该装置推断右侧烧杯中反应的热效应,故D正确; 故选AD. |
| 点评: | 本题考查了化学平衡影响因素分析判断,化学平衡移动原理理解应用,注意反应特征的分析应用,掌握基础是关键,题目难度中等. |


科目:高中化学 来源: 题型:
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s) △H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s) △H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H= 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,
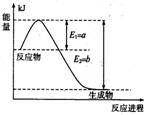
请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为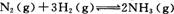 在一定温度下,
在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度 C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示

铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应叙述相符合的是( )
|
| A. | 图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
|
| B. | 图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
|
| C. | 图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
|
| D. | 图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
|
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 |
|
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
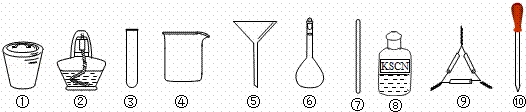
|
| A. | 将茶叶灼烧灰化,选用①、②和⑨ |
|
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
|
| C. | 过滤得到的滤液,选用④、⑤和⑦ |
|
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,还含有CCl4、I2、I﹣)中回收碘,其实验过程如图1:
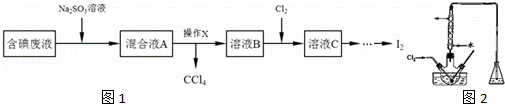
(1)向含碘废液中加入稍过量的Na2SO3溶液时发生的离子方程式为 ;该操作的目的是 .
(2)操作X应在 (填写仪器名称图2)中进行,简述得到溶液B的过程:将混合溶液静置后,
(3)在三颈瓶中将溶液B用盐酸调至pH约为2,缓慢通入Cl2,在40˚C左右反应(实验装置如右图所示).实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 (填溶质的化学式).
(4)某含碘废水(pH约为4)中一定存在I2,可能存在I﹣或IO3﹣.可以使用 (填溶质的化学式,下同)溶液检验可能存在的I﹣或 溶液检验可能存在的IO3﹣.在检验该含碘废水中是否含有I﹣或IO3﹣前必需要进行的操作是 (填序号).
a.取适量含碘废水用CCl4多次萃取、分液
b.用NaOH溶液将溶液调节到中性
c.向溶液中滴入少量淀粉溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
己知:|||+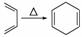 ,如果要合成
,如果要合成 ,所用的起始原料可以是
,所用的起始原料可以是
①2甲基1,3丁二烯和2丁炔 ②1,3戊二烯 和2丁炔 ③2,3二甲基1,3戊二烯和乙炔 ④2,3二甲基1,3丁二烯和丙炔
和2丁炔 ③2,3二甲基1,3戊二烯和乙炔 ④2,3二甲基1,3丁二烯和丙炔
A、①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO4-、Cl-
C.pH<7的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com