
| A. | 该反应属于置换反应 | |
| B. | 该反应利用了KClO3的强氧化性 | |
| C. | 氧化剂与还原剂的物质的量之比为1:6 | |
| D. | 该反应中有5mo1电子转移时,则一定生成67.2L Cl2 |
分析 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,1molKClO3中Cl元素的化合价由+5价降低为0作氧化剂,5molHCl中的Cl元素的化合价由-1价升高为0作还原剂,以此来解答.
解答 解:A.该反应没有单质参加,所以不属于置换反应,故A错误;
B.KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,1molKClO3中Cl元素的化合价由+5价降低为0作氧化剂,利用了KClO3的强氧化性,故B正确;
C.KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,1molKClO3中Cl元素的化合价由+5价降低为0作氧化剂,5molHCl中的Cl元素的化合价由-1价升高为0作还原剂,所以氧化剂与还原剂的物质的量之比为1:5,故C错误;
D.未指明标况下,无法计算体积,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素化合价变化为解答的关键,侧重氧化还原基本概念的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
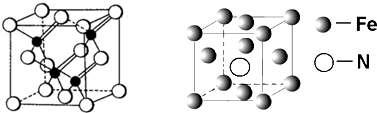
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
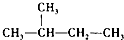 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
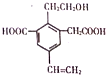
| A. | 1mol该物质,最多可以加成4molH2 | |
| B. | 该物质消耗Na、NaOH、NaHCO3的物质的量比为3:2:2 | |
| C. | 可以用酸性高锰酸钾溶液检验其中的碳碳双键 | |
| D. | 该物质能够在催化剂作用下被氧化为含醛基的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=2I2+4OH- | |
| C. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | 氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
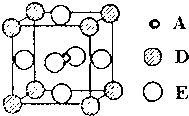 A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2.
A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 1,3-丁二烯与足量氢气加成(丁烷) | |
| C. | 氯气与苯用氯化铁作催化剂反应(氯苯) | |
| D. | 等物质的量的氯气与乙烷在光照条件下反应(氯乙烷) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1molCPAE与NaOH溶液,浓溴水和氢气反应时最多消耗的NaOH、Br2和H2的物质的量分别是3mol、4mol和7mol | |
| B. | 咖啡酸分子中至少有9个碳原子共平面 | |
| C. | 咖啡酸、苯乙醇及CPAE都能发生取代,加成和消去反应 | |
| D. | 用FeCl3溶液可以检测上述反应中是否有CPAE生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com