
| A. | 当体系的体积不再发生变化,该反应已建立平衡 | |
| B. | 达到平衡后向体系中充入少量He,平衡不移动 | |
| C. | 增大水蒸气的用量可以提高碳粉的转化率 | |
| D. | 若断裂1 molH-H键的同时断裂2molH-O键,则反应达到平衡 |
分析 A、根据化学平衡状态的特征解答,因为是容积可变的密闭容器中,所以体系的体积不再发生变化,说明反应达平衡状态;
B、密闭容器容积可变则充入He气,则容器的容积增大,各组分的浓度发生变化,平衡发生移动;
C.增大水蒸气的浓度,平衡正向移动;
D、l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键.
解答 解:A、因为是容积可变的密闭容器中,所以体系的体积不再发生变化,说明反应达平衡状态,故A不选;
B、密闭容器容积可变则充入He气,则容器的容积增大,各组分的浓度发生变化,平衡发生移动,故B选;
C、增大水蒸气的浓度,反应速率增大,平衡正向移动,碳的转化率也增大,故C不选;
D、l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故D不选.
故选B.
点评 本题考查化学平衡状态的判断、平衡移动原理的应用,属于基本知识的考查,注意知识的积累是解题的关键,难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | 钠与W可以形成离子化合物Na2W2 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | 氧化物对应水化物的酸性:Q>W | |
| D. | 固态XY2和ZY2的化学键类型、晶体类型都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫能预测钋在地球上的分布 | B. | 钋在第七周期第ⅥA族 | ||
| C. | 钋的最外层电子数为6 | D. | 钋属于副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 煤炭燃烧前经过脱硫处理可减少酸雨的产生 | |
| C. | 燃料电池是一种高效、友好的发电装置,可将化学能完全转化为电能 | |
| D. | 太阳能的利用,一般是将太阳辐射能先转化为热能、电能或化学能,再加以利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子价层电子中有两个未成对电子 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
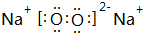 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s | |
| 1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
| 2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
| 3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
| 4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O | |
| B. | Na放入水中,产生气体:Na+H2O=Na++OH-+H2↑ | |
| C. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com