
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )
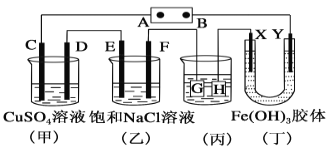
A.电源B极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
【答案】D
【解析】
将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,B是电源的负极,A是电源的正极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极。
A.根据上述分析可知B电极是电源的负极,A错误;
B.甲装置中,阳极C电极反应式为:4OH--4e-=O2↑+2H2O,阴极D电极反应式为:Cu2++2e-=Cu;乙装置是阳极E的电极反应为:2Cl--2e-=Cl2↑,阴极F电极的电极反应式为:2H++2e-=H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2,B错误;
C.电镀装置中,镀层金属必须作阳极,镀件作阴极,所以H应该是镀件,G是镀层金属,电解质溶液必须是含镀层金属离子的盐溶液,用(丙)装置给铜镀银,G应该是Ag,电镀液选用AgNO3溶液,C错误;
D.装置(丁)中Y极附近红褐色变深,证明氢氧化铁胶体微粒移向Y极,依据上述判断,X为阳极,Y为阴极,氢氧化铁胶体向Y电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,D正确;
故合理选项是D。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】生物材料衍生物2,5-呋喃二甲酸(![]() )可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF)。下列说法正确的是
)可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF)。下列说法正确的是
A. 合成PEF的反应为加聚反应
B. PEF不能与氢气发生加成反应
C. 通过红外光谱法测定PEF的平均相对分子质量,可得其聚合度
D. 聚对苯二甲酸乙二醇酯的结构简式为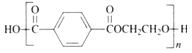
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
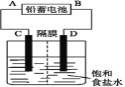
已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO42--2e- =PbSO4
正极PbO2+4H++SO42-+2e- =PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式_________________________。
(2)若在电解池C极一侧滴酚酞溶液,电解一段时间后未呈红色,说明铅蓄电池的A极为____极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g/cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________ mol。
②铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为__________L。
③消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出)__________________________________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B.二氯甲烷有两种结构
C.0.1 mol的烃能被标准状况下4.48 L H2加成,则此烃一定含有碳碳三键
D.甲苯能使酸性高锰酸钾褪色,而甲烷不能,这是因为基团间的相互影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)结构简式为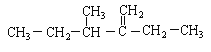 此烃名称为_______________。
此烃名称为_______________。
(2)某烷烃被命名为3,5-二甲基-2—乙基己烷,该名称不正确,正确的命名为________________。
(3)在实验室鉴定1-氯丙烷中氯元素的操作步骤是____________(填序号)。
①滴加AgNO3溶液;②加NaOH溶液;③加热;④用HNO3酸化;
(4)乙基香草醛(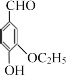 )是食品添加剂的增香原料,其香味比香草醛更加浓郁。写出乙基香草醛分子中官能团称___________、___________、___________。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。写出乙基香草醛分子中官能团称___________、___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定是分析化学中最要的分析方法之一,根据其原理回答下列问题:
I、酸碱中和滴定是最基本的滴定方法:
(1)滴定管是酸碱中和滴定中重要的仪器,向25mL碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为10.00mL,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为____________(填“大于”、“小于”或“等于”)15.00mL。
(2)向碱式滴定管中注入标准的氢氧化钠溶液之前的一步操作为(_______________)
(3)准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.1000 mol/LNaOH溶液滴定。下列说法正确的是(______)
A.锥形瓶用蒸馏水洗涤后,用待测HCl溶液润洗
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏大
II、氧化还原滴定也是分析化学中常用的分析手段,用氧化还原滴定方法测定粗品中Na2S2O35H2O的质量分数。
实验步骤:称取6g粗品配制250mL的溶液待用。用酸式滴定管取25.00mL0.01mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点(反应为I2+2S2O32-=2I﹣+S4O62﹣),消耗Na2S2O3溶液25.00mL。回答下列问题:
(1)向K2Cr2O7溶液中加入过量的KI溶液并酸化,Cr2O72-被还原成Cr3+,写出该反应的离子方程式_____。
(2)用Na2S2O3溶液滴定至终点的现象为_________________________。
(3)粗品中Na2S2O35H2O的质量分数为___________________。
(4)若在取K2Cr2O7溶液时有部分溶液滴到了锥形瓶外,则测定结果偏_________(填“高”、“低”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是
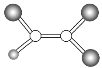
A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有碳碳双键
C.该有机物分子中的所有原子在同一平面上
D.该有机物分子中形成的化学键都是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种直接铁燃料电池(电池反应为3Fe+2O2=Fe3O4)的装置如图所示,下列说法正确的是( )
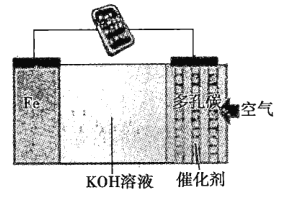
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6gFe参与反应,导线中转移1.204×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
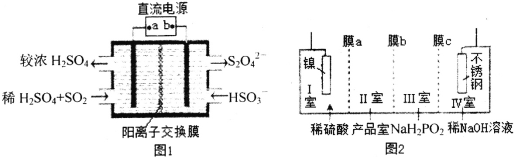
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g) ![]() 2SO3(g)。
2SO3(g)。
已知:标准平衡常数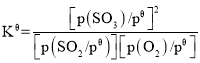 ,其中
,其中![]() 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为![]() ,则
,则![]() _______(用含
_______(用含![]() 的最简式表示)。
的最简式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com