
 在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )
在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )| A. | 在t℃时,AgI的Ksp=2.5×10-15 mol2•L-2 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常数K=200 |
分析 A.根据c点银离子、碘离子的浓度计算t℃时AgI的Ksp;
B.b点时碘离子浓度大于5×10-8mol/L,此时为碘化银的过饱和溶液;
C.向c点溶液中加入适量蒸馏水,碘离子浓度一定减小,则c(I-)<5×10-8mol/L;
D.t℃时,反应AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常数K=$\frac{c(B{r}^{-})}{c({I}^{-})}$=$\frac{{K}_{sp}(AgBr)}{{K}_{sp}(AgI)}$.
解答 解:A.t℃时,根据图象中c点银离子、溴离子浓度分别为:c(I-)=5×10-8mol/L,c(Ag+)=5×10-8mol/L,则Ksp(AgI)=c(I-)×c(Ag+)=5×10-8mol/L×5×10-8mol/L=2.5×10-15 mol2•L-2,故A正确;
B.b点c(Ag+)=5×10-8mol/L,c(I-)>5×10-8mol/L,则c(I-)×c(Ag+)>Ksp(AgI),所以会析出AgI沉淀,故B正确;
C.向c点溶液中加入适量蒸馏水,溶液体积增大,导致c(I-)<5×10-8mol/L,不可能使溶液由c点到a点,故C错误;
D.t℃时,Ksp(AgI)=c(I-)×c(Ag+)=2.5×10-15,Ksp(AgBr)=5×10-13,反应AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常数K=$\frac{c(B{r}^{-})}{c({I}^{-})}$=$\frac{{K}_{sp}(AgBr)}{{K}_{sp}(AgI)}$=$\frac{5×1{0}^{-13}}{2.5×1{0}^{-15}}$=200,故D正确;
故选C.
点评 本题考查了难溶物溶解平衡及其影响,题目难度中等,明确难溶物溶度积的概念及表达式为解答关键,注意掌握难溶物溶解平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | B的最高价氧化物对应的水化物的酸性比E强 | |
| B. | 某物质焰色反应呈黄色,该物质一定是含C的盐 | |
| C. | 向D单质与沸水反应后的溶液中滴加酚酞,溶液变红 | |
| D. | B的氢化物的沸点一定高于A的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
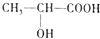 )都是生活中常见的有机物,请按要求完成下列问题;
)都是生活中常见的有机物,请按要求完成下列问题;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
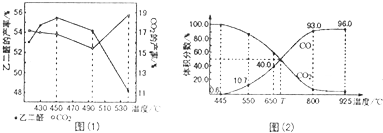
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
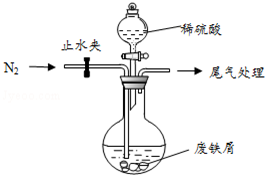 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
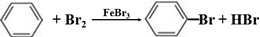
| A. | 催化剂存在条件下苯与溴反应制溴苯 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 一定条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 光照条件下,乙烷与氯气反应制氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温时,三个反应的反应物的活化分子百分数均增加 | |
| B. | 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | |
| C. | 常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | |
| D. | 降温时,三个反应的化学反应速率均减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
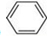 ;
; ,A的二溴代物的同分异构体有3种;
,A的二溴代物的同分异构体有3种;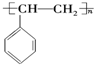 ,其单体是
,其单体是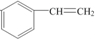 (填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式
(填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式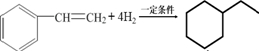 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com