
【题目】如图所示的电解装置可实现低电位下高效催化还原CO2。下列说法不正确的是( )
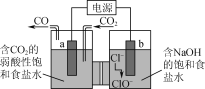
A.a极连接外接电源的负极
B.电解过程中Na+从右池移向左池
C.b极的电极反应式为Cl--2e-+H2O=ClO-+2H+
D.外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L
【答案】C
【解析】
从图示中可以看出,b电极上Cl-失去电子生成ClO-,b电极为电解池阳极;a电极上CO2得到电子生成CO,a电极为电解池阴极;与b极相连的电池一极为正极,与a极相连的电池一极为负极。
A.根据分析,a极与外电路相连的一极为负极,A正确;
B.根据分析,阴极反应为CO2+2e-+H2O=CO+2OH-,生成大量阴离子,为平衡电荷,Na+向左边移动,B正确;
C.因右池电解液中含有大量的OH-,故电极方程式中不能出现H+,正确的电极方程式为Cl--2e-+2OH-=H2O+ClO-,C错误;
D.根据B选项的电极反应,每转移2mol电子,可还原标况下22.4L的CO2,故电路中转移1mol电子,可还原标况下11.2L的CO2,D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O
(实验内容及记录)
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据表中的实验数据,可以得到的结论是____。
(2)利用实验1中数据计算,所在时间内用KMnO4的浓度变化表示的平均反应速率为:v(KMnO4)=____。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
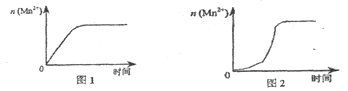
①该小组同学提出的假设是____。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 1.0 | 2.0 | ___ | t |
③若该小组同学提出的假设成立,应观察到的现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。
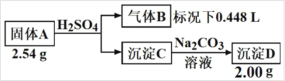
气体B为黄绿色气体单质, 沉淀C和D焰色反应为均为砖红色。
(1)组成A的三种元素是______,A的化学式是______
(2)固体A与足量稀硫酸反应的化学方程式是______。
(3)请从化学反应原理的角度解释(结合化学方程式)为什么沉淀C能转化成 D______。
Ⅱ.常用的补铁剂有硫酸亚铁等,而乳酸亚铁被人体吸收的效果比无机铁好,它溶于水形成淡绿色的透明溶液,几乎不溶于乙醇。它的制备方法有两种:一是在FeCO3中加入乳酸;二是利用废铁屑制取纯净的三水合乳酸亚铁晶体,其实验流程如下图所示:
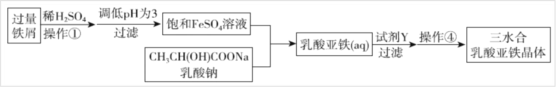
(1)写出制备方法一的离子反应方程式_______;
(2)操作①中不需要用到的仪器为________;
A.玻璃棒 B.坩埚 C.坩埚钳 D.蒸发皿
(3)加入过量的试剂Y为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是
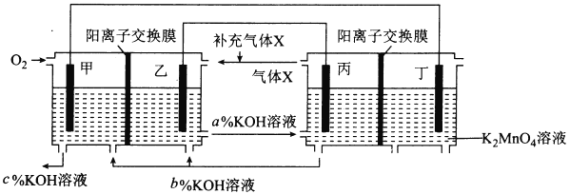
A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,
通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如下图所示。
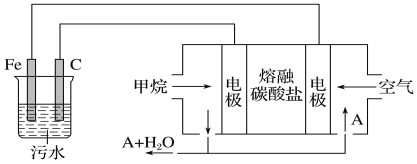
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_____________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①正极的电极反应式为______________________________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是___________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中所用少量氯气是用MnO2和浓盐酸制取的,用浓盐酸200ml,其密度为1.19g·cm-3,HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了11.2L(标况)的氯气。试计算:
①浓盐酸的物质的量浓度?___
②求参加反应的HCl的物质的量?___
③被氧化的HCl的质量?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480mL1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有____。
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是____(填操作序号)。
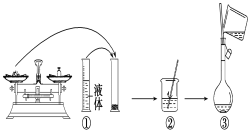
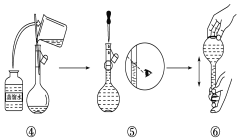
(3)称取NaOH固体时,所需砝码的质量为____(填写字母)。
A. 19.2g B. 20g C. 19.2g ~20g D. 大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的序号)___ 。
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)下列操作会导致所配溶液的物质的量浓度偏高的是____。
A.配制NaOH溶液时,NaOH固体中含有Na2O杂质
B.用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容
C.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
D.定容时仰视刻度线
E.用托盘天平称量 NaOH 固体时,砝码生锈
F.配制前容量瓶中有少量水滴
(6)若某同学用密度为1.2g/cm3,质量分数为36.5%的浓盐酸配制100mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__。
(3)①甲同学认为:实验Ⅱ观察到__现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先③步骤步骤,,,,,加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是__。
(4)综合实验Ⅰ和Ⅲ,得出氧化性Cl2>Br2>I2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com