
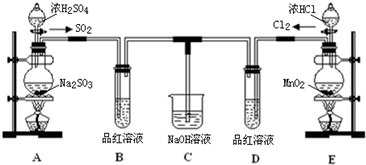
分析 (1)依据分液漏斗使用方法解答:使用分液漏斗时应使分液漏斗上边的活塞打开或者是其凹槽对准漏斗上口的小孔,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(3)SO2的漂白具有可逆性;次氯酸漂白不具有可逆性;
(4)二氧化硫与氯气等物质的量反应生成盐酸和硫酸,盐酸和硫酸都不具有漂白性.
解答 解:(1)使用分液漏斗时应使分液漏斗上边的活塞打开或者是其凹槽对准漏斗上口的小孔,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
故答案为:分液漏斗上边的活塞未打开或者是其凹槽未对准漏斗上口的小孔;
(2)反应中二氧化锰中锰元素从+4价降为氯化锰中+2价,部分氯化氢中-1价的氯升高为氯气中0价,要使氧化还原反应得失电子守恒,则二氧化锰系数为1,氯气系数为1,依据原子个数守恒,反应方程式为:;
故答案为:MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 1MnCl2+2H2O+Cl2↑;
故答案为:1;4;1;Cl2↑;2H2O;
(3)SO2的漂白具有可逆性;次氯酸漂白不具有可逆性,所以看到现象为:B中溶液变成红色,D中溶液颜色无变化;
故答案为:B中溶液变成红色,D中溶液颜色无变化;
(4)二氧化硫与氯气等物质的量反应生成盐酸和硫酸,盐酸和硫酸都不具有漂白性,化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评 本题考查了氯气和二氧化硫的漂白性质,注意掌握氯气和二氧化硫性质,注意二氧化硫的漂白性与次氯酸的漂白性根本区别,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 用图②所示装置,分离CCl4萃取I2水后的有机层和水层 | |
| C. | 除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后过滤 | |
| D. | 称取0.40gNaOH,放入100mL容量瓶中,配制0.10mol•L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
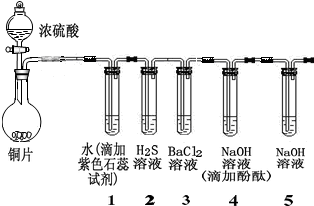
| 加入的物质 | O2 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na暴露于空气中最终生成Na2O2 | |
| B. | 铜粉能溶于酸性硝酸钠溶解 | |
| C. | Fe比Al更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉会有红棕色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
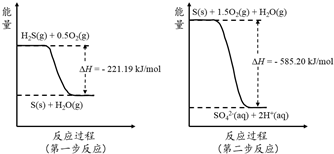
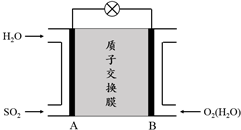
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中 Mg2+、Al3+、SO42-、CO32- | |
| B. | pH=1的溶液中 NH4+、Ba2+、HCO3-、NO3- | |
| C. | 含MnO4-的溶液中 H+、K+、Br-、I- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中 Na+、K+、CH3COO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
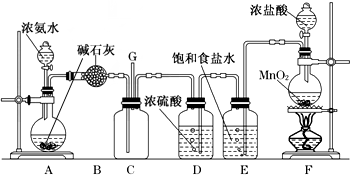
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com