
【题目】某有机物A的红外光谱和核磁共振氢谱图如下图所示,下列说法中错误的是
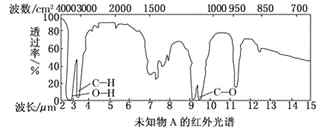
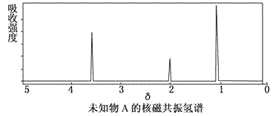
A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
C. 仅由其核磁共振氢谱图无法得知其分子中的氢原子总数
D. 由核磁共振氢谱图可知,该有机物分子中有三种不同的氢原子
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol/L,则此时v(正)<v(逆)
C. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D. 恒温时将气体体积缩小到原来的一半,达到新平衡时CO浓度将要减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的价电子排布式_____________,基态Mn原子核外电子的运动状态有___种;
(2)①CoTiO3晶体结构模型如图1所示,晶胞参数a=0.53nm。在CoTiO3晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为________个、________个。
②列式表示CoTiO3晶体的密度:________g.cm-3(不必计算出结果,用NA表示阿伏加德罗常数的值)。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为___________、___________(各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
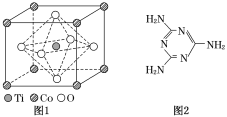
三聚氰胺分子中氮原子轨道杂化类型是____________,1 mol三聚氰胺分子中σ键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
(资料查阅)
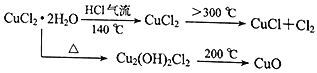
(实验探究)该小组用下图所示装置进行实验(夹持仪器略)。
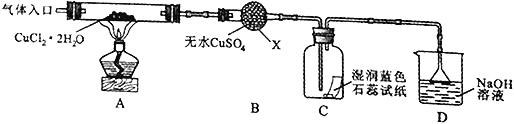
请回答下列问题:
(1)实验操作的先后顺序是a→_______________→e(填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(2)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_______。
(3)装置D中发生的氧化还原反应的离子方程式是________________。
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息
①若杂质是CuCl2,则产生的原因是________________。
②若杂质是CuO,则产生的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
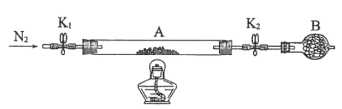
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
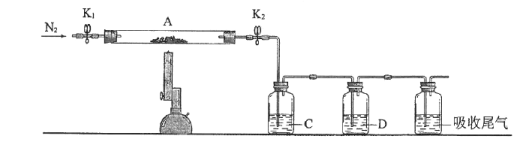
①C、D中的溶液依次为______(填标号)。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②C、D中有气泡冒出,并可观察到的现象分别为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析、归纳、探究是学习化学的重要方法和手段之一。下面就电解质A回答有关问题 (假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a
①当a =10时,A溶液呈碱性的原因是(用离子方式程式表示)___________________。
②当a =11,n =1时,A溶液中各种离子浓度由大到小的顺序为_____________________, c(OH-)-c(HB)=________ mol/L。
③当n=1、c=0.1,溶液中c(HB)∶c(B-)=1∶999时,A溶液的pH为______(保留整数值)。
(2)已知难溶电解质A的化学式为XY2,测得其饱和溶液中X2+离子的浓度为c mol/L,则该难溶物XY2的溶度积常数为Ksp=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经过多方努力,郑州市的空气质量有明显改善。造成雾霾的重要原因之一是汽车尾气的排放,汽车加装尾气处理装置可以减少有害尾气的排放。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如下图所示。下列说法错误的是
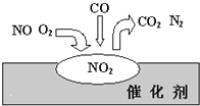
A. NO2是该过程的中间产物
B. 汽车尾气的主要污染成分为CO和NO
C. NO和O2必须在催化剂表面才能反应
D. 该催化转化的总反应方程式:2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com