
| A. | 两者都是酸性氧化物,故均不与酸反应 | |
| B. | 两者都可以与NaOH溶液反应 | |
| C. | CO2 的溶沸点比SiO2高 | |
| D. | 两者都能与水反应生成对应的酸且碳酸的酸性大于硅酸 |
科目:高中化学 来源: 题型:解答题
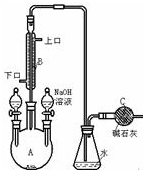 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | F | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 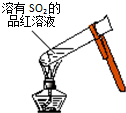 加热后溶液颜色变为无色 加热后溶液颜色变为无色 | |
| B. | 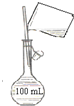 配制100 mL 0.10 mol•L-1NaCl溶液 配制100 mL 0.10 mol•L-1NaCl溶液 | |
| C. | 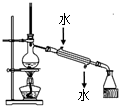 实验室用该装置制取少量蒸馏水 实验室用该装置制取少量蒸馏水 | |
| D. | 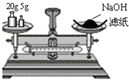 称量25 g NaOH 称量25 g NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com