
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
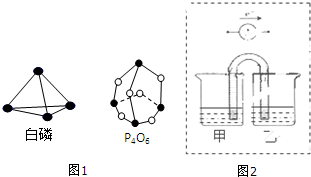
分析 (1)反应热=反应物总键能-生成物总键能,注明物质的聚集状态,书写热化学方程式;
(2)Cu发生氧化反应,为原电池负极,Fe3+发生还原反应,在原电池正极反应,用石墨作正极材料,电子由负极经过导线流向正极,甲池发生氧化反应,应为CuSO4溶液、乙中为Fe2(SO4)3溶液;
(3)①根据电荷守恒判断溶液酸碱性,利用电荷守恒计算溶液中H+离子浓度,若为碱性,忽略氢离子,若为酸性,忽略氢氧根离子,再根据pH=-lgc(H+)计算;
②计算平衡时各组分物质的量,反应前后气体化学计量数不变,利用物质的量代替浓度代入平衡常数表达式K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$计算;
升高温度,反应速率加快,平衡右移,单位时间内NO排放量增大.
解答 解:(1)发生反应:P4(s,白鳞)+3O2(g)═P4O6(s),反应热△H=6×198kJ•mol-1+3×498 kJ•mol-1-12×360kJ•mol-1=-1638kJ•mol-1,反应热化学方程式为:P4(s,白鳞)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1,
故答案为:P4(s,白鳞)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1;
(2)Cu发生氧化反应,为原电池负极,Fe3+发生还原反应,在原电池正极反应,用石墨作正极材料,电子由负极经过导线流向正极,补充完整装置图为: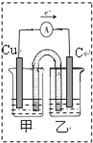 ,甲乙两池中电解质元素种类始终保持不变,甲池发生氧化反应,应为CuSO4溶液、乙中为Fe2(SO4)3溶液,
,甲乙两池中电解质元素种类始终保持不变,甲池发生氧化反应,应为CuSO4溶液、乙中为Fe2(SO4)3溶液,
故答案为: ;CuSO4;Fe2(SO4)3溶液;
;CuSO4;Fe2(SO4)3溶液;
(3)①由电荷守恒可知,c(K+)+c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(Cl-)+2c(SO42-)+c(NO3-),则c(H+)-c(OH-)=(2×10-5 +2×4×10-5 +3×10-5-4×10-6-6×10-6-2×10-5 )mol/L=10-4mol/L,溶液呈酸性,溶液中H+离子浓度约是为10-4,pH值=-lgc(H+)=4,
故答案为:酸性;4;
②N2(g)+O2(g)?2NO(g)
开始(mol):0.8 0.2 0
转化(mol):4×10-4 4×10-4 8×10-4
平衡(mol):0.8 0.2 8×10-4
反应前后气体化学计量数不变,利用物质的量代替浓度计算平衡常数,故K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$=$\frac{(8×1{0}^{-4})^{2}}{0.8×0.2}$=4×10-6;
正反应为吸热反应,升高温度,反应速率加快,平衡右移,单位时间内NO排放量增大,
故答案为:4×10-6;正反应为吸热反应,升高温度,反应速率加快,平衡右移.
点评 本题考查热化学方程式书写、原电池、溶液酸碱性判断与pH计算、平衡常数计算、化学反应速率与化学平衡影响因素等,属于拼合型题目,需要学生具备扎实的基础,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | ①②③ | B. | ①④⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于高分子化合物 | |
| B. | 水解后可得到多种氨基酸 | |
| C. | 可用于蛋白质反应机理的研究 | |
| D. | 加入CuSO4溶液后所得的沉淀能用溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
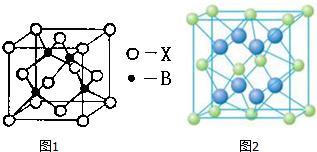
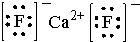 .则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.
.则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com