
关于下列各图的叙述中不正确的是

A.已知CO的燃烧热为283 kJ/mol,2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+ 、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1
C.在常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,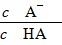 的变化情况
的变化情况
C
【解析】A选项,CO燃烧的热化学方程式为
CO(g)+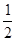 O2(g)===CO2(g) ΔH1=-283 kJ/mol,
O2(g)===CO2(g) ΔH1=-283 kJ/mol,
H2(g)+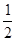 O2(g)===H2O(g) ΔH2=-241.8 kJ/mol,
O2(g)===H2O(g) ΔH2=-241.8 kJ/mol,
用方程式一减去方程式二得CO(g)+H2O(g)===CO2(g)+H2(g),故ΔH=ΔH1-ΔH2=-283 kJ/mol+241.8 kJ/mol=-41.2 kJ/mol;B选项,NH3·H2O是弱碱,盐酸是强酸,pH=1的盐酸溶液中溶质的浓度等于溶液中c(H+)=0.1 mol/L,酸与碱等体积混合恰好反应说明氨水中溶质浓度恰好等于盐酸中溶质浓度,即NH3·H2O溶液中溶质浓度为0.1 mol/L,反应后溶液体积变成原来两倍,由N元素守恒知混合溶液中NH、NH3·H2O与NH3三者浓度和为0.1 mol/L×V L÷2V L=0.05 mol/L;D选项,HA是弱酸,溶液中存在电离方程式:HA H++A-,电离平衡常数
H++A-,电离平衡常数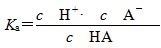 ,温度一定,Ka是个常数,
,温度一定,Ka是个常数,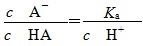 ,稀释过程中c(H+)逐渐减小,故
,稀释过程中c(H+)逐渐减小,故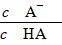
逐渐增大。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0mol·L-1的KNO3溶液:Cl-、SO42-、H+、Fe2+
B.c(H+)=1.0×10-12mol·L-1的溶液:K+、Na+、CH3COO-、Br-
C.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
NA代表阿伏加德罗常数,下列说法错误的是
A.标准状况下,22.4 L NO和22.4 L O2的混合, 混合气体中含有的氧原子数为3NA
B.0.012 kg 13C中,含中子数为7NA
C.25 ℃时,1 L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子
D.在反应3SiO2+6C+2N2  Si3N4+6CO ,生成1 mol Si3N4时共转移12 NA电子
Si3N4+6CO ,生成1 mol Si3N4时共转移12 NA电子
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:推断题
化合物A是合成天然橡胶的单体,分子式为C5H8,A的一系列反应如下(部分反应条件略去)
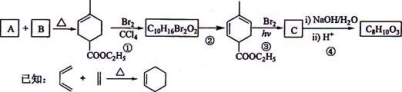
回答下列问题:
(1)A的结构简式为 ,化学名称是 ;
(2)B的分子式为 ;
(3)②的反应方程式为 ;
(4)①和③的反应类型分别是 , ;
(5)C为单溴代物,分子中有两个亚甲基,④的化学方程式为 ;(6)A的同分异构体中不含聚集双烯(C=C=C)结构单元的链状烃还有 种,写出其中互为立体异构体的化合物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
下列关于物质结构、性质的说法正确的是
A.因为酸性:HCl>H2CO3,所以非金属性:Cl>C
B.同一周期元素的原子,半径越小越容易失去电子
C.K的原子半径比Na的原子半径大,K与水反应比Na与水反应更剧烈
D.离子化合物中可能含有共价键,共价化合物中可能含有离子键
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是
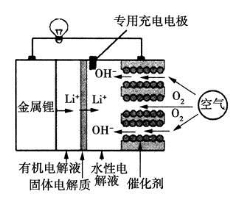
A.该电池放电时,正极的反应式为O2+4e-+4H+===2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-===Li
C.电池中的有机电解液可以用稀盐酸代替
D.正极区产生的LiOH可回收利用
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:简答题
氯丁橡胶E(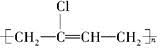 )的合成路线如下:
)的合成路线如下:
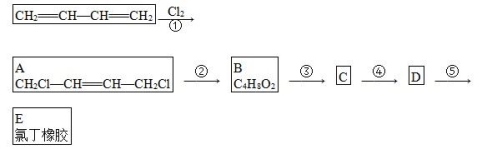
已知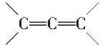 是不稳定结构。
是不稳定结构。
(1)氯丁橡胶中官能团的名称是________。
(2)②的反应条件和无机试剂是________。
(3)若A为反式结构,用结构简式表示A的结构是____________。
(4)④的化学方程式是______________________。
(5)B的同分异构体有多种,写出属于酯类且能发生银镜反应的所有同分异构体的结构简式:____________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:简答题
某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为___________、______________。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:__________。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为____________。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如下:
ⅰ.H2O2ⅱ.调pHNaClO/NaOH混合溶液
①测得滤液中c(Fe2+)为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25%的H2O2溶液________kg(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.在标况下, 11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2晶体中含有0.4NA个离子
D.铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com