
| A. | 从海水中富集含微量元素的化合物 | B. | 使含微量元素的离子沉淀 | ||
| C. | 对含微量元素的混合物进行提纯 | D. | 从化合物中冶炼这些单质 |
分析 A.微量元素的化合物总量多,浓度小,富集困难;
B.使含微量元素的离子沉淀,只需要加入试剂沉淀;
C.对含微量元素的混合物进行提纯也可以利用离子性质加入试剂,通过合适的试剂反应分离提纯;
D.从化合物中冶炼这些单质,利用试剂加入发生氧化还原反应可以得到;
解答 解:A.海水中金、铀等微量元素的总量很大,但由于海水总量极大,故其浓度很低,而富集微量元素的化合物很困难,成本很高,故A正确;
B.使含微量元素的离子沉淀,只需要加入试剂沉淀获得较易,故B错误;
C.对含微量元素的混合物进行提纯也可以利用离子性质加入试剂,通过合适的反应和实验操作分离提纯,故C错误;
D.从化合物中冶炼这些单质,利用试剂加入发生氧化还原反应可以得到单质,故D错误;
故选A.
点评 本考查了海水资源的利用,主要是获取微量元素的方法分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 28gCO和N2混合气体中含有原子总数为2NA | |
| B. | 在1L1mol•L-1的氨水中含有NA个NH3分子 | |
| C. | 标准状况下,11.2LNO和11.2LO2混合后气体分子数为NA | |
| D. | 1mol Fe分别与足量Cl2、S反应,Fe失去电子数都为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| B. | Na2O2与H2O反应生成1.12L(标况)氧气,反应中转移电子的电子数为0.1NA | |
| C. | 1molNa与足量氧气反应,失去的电子数目为NA | |
| D. | 78gNa2O2固体中阴离子个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(2b-a)kJ•mol-1 | |
| B. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(b-a)kJ•mol-1 | |
| C. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2b-a)kJ•mol-1 | |
| D. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(2b+a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
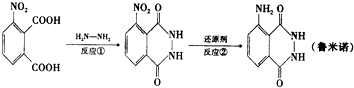
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| B. | 铝粉与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| C. | 利用腐蚀法制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 在氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com