
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)??? △H =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g)?? △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为??????????????????????????????? 。???????
 (2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  ? 2N2(g)+3H2O(g) ΔH < 0
? 2N2(g)+3H2O(g) ΔH < 0
为提高氮氧化物的转化率可采取的措施是????????????????? (写出1条即可)。
(3)利用ClO2 氧化氮氧化物。其转化流程如下:
NO NO2
NO2 N2
N2
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是?? ????????????? ;若生成11.2 L N2(标准状况),则消耗ClO2 ??????? g 。
(4)利用CO催化还原氮氧化物也可以达到消除污染的目的。
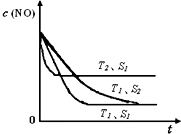
已知质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图是反应2NO(g) + 2CO(g)  2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H????? 0 (填“>”、“<”或“无法确定”);催化剂表面积S1????? S2 (填“>”、“<”或“无法确定”)。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H????? 0 (填“>”、“<”或“无法确定”);催化剂表面积S1????? S2 (填“>”、“<”或“无法确定”)。

(1)CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)??? △H =-867 kJ/mol???? (3分)
(2)增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(合理答案也计分)
(3)2NO2 + 4 Na2SO3 = N2 + 4 Na2SO4????? 67.5
(4)<?????? >
【解析】
试题分析:(1)将已知的两个热化学方程式相加除以2即得,答案为CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)??? △H =-867 kJ/mol?
(2)提高氮氧化物的转化率即使反应正向进行,根据勒夏特列原理,可采取增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等措施;
(3)反应Ⅱ中反应物为NO2 、Na2SO3,产物之一有N2,根据氧化还原反应理论,可推断另一产物为Na2SO4化学方程式是2NO2 + 4 Na2SO3 = N2 + 4 Na2SO4;若生成11.2 L N2(标准状况),其物质的量为0.5mol,消耗NO2的物质的量为1mol,从而可计算出消耗ClO2的质量为67.5g;
(4)根据化学平衡中的“先拐先平”规律,温度高的先达平衡,表面积大的速率快,先达平衡,所以T2>T1,S1>S2,随温度升高,CO的浓度增大,说明升温平衡逆向移动,正向是放热反应△H<0。
考点:考查盖斯定律的应用、平衡移动与外界条件的关系、化学方程式的推断及计算、化学平衡图像的分析能力


科目:高中化学 来源: 题型:阅读理解
| V(臭氧空气) | V(烟气) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.| 180℃ |
| 催化剂 |
| ClO2 |
| 反应Ⅰ |
| Na2SO3 |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省漳州市八校高三第三次联考理综化学试卷(解析版) 题型:填空题
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?? △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)? △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为:??????????? ???????????? 。
 (2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为: 为提高氮氧化物的转化率可采取的措施是???????? ????????????????????????? (写出1条即可)。
为提高氮氧化物的转化率可采取的措施是???????? ????????????????????????? (写出1条即可)。
(3)利用ClO2 氧化氮氧化物。其转化流程如下:? NO NO2
NO2 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是???????? ????? ;若生成11.2 L N2(标准状况),则消耗ClO2 ??????? g 。
N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是???????? ????? ;若生成11.2 L N2(标准状况),则消耗ClO2 ??????? g 。
(4)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol?L-1/ 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①T1℃时,该反应的平衡常数K= ????????? (保留两位小数).②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ????????????? .③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H ?? 0(填“>”、“=”或“<”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com