
分析 平均反应速率vC=$\frac{1}{2}$vA;反应2min时,A的浓度减少了$\frac{1}{3}$,
则vA=$\frac{\frac{amol}{2L}×\frac{1}{3}}{2min}$=$\frac{a}{12}$mol/(L•mim),vC=$\frac{a}{24}$mol/(L•mim),
B的物质的量减少了$\frac{a}{2}$ mol,
vB=$\frac{\frac{\frac{a}{2}mol}{2L}}{2min}$=$\frac{a}{8}$mol/(L•mim),
有a mol D生成,vD=$\frac{\frac{amol}{2L}}{2min}$=$\frac{a}{4}$mol/(L•mim),
由反应速率之比等于化学计量数之比可知,反应为2A(g)+3B(g)?C(g)+6D(g),
2A(g)+3B(g)?C(g)+6D(g),
开始a b 0 0
转化 a 2a
平衡 2a
结合温度、压强对平衡移动的影响来解答.
解答 解:(1)平均反应速率vC=$\frac{1}{2}$vA;反应2min时,A的浓度减少了$\frac{1}{3}$,
则vA=$\frac{\frac{amol}{2L}×\frac{1}{3}}{2min}$=$\frac{a}{12}$mol/(L•mim),vC=$\frac{a}{24}$mol/(L•mim),
B的物质的量减少了$\frac{a}{2}$ mol,
vB=$\frac{\frac{\frac{a}{2}mol}{2L}}{2min}$=$\frac{a}{8}$mol/(L•mim),
有a mol D生成,vD=$\frac{\frac{amol}{2L}}{2min}$=$\frac{a}{4}$mol/(L•mim),
由反应速率之比等于化学计量数之比可知,反应为2A(g)+3B(g)?C(g)+6D(g),
故答案为:2;3;1;6;
(2)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则升高温度逆向移动,正反应为放热反应,△H<0,
故答案为:<;
(5)①将容器的容积变为1L,相当于压强增大,则反应速率增大,
故答案为:增大;
②将容器的容积变为1L,相当于压强增大,平衡逆向移动,转化率减小,
故答案为:减小;压强增大,平衡逆向移动,转化率减小.
点评 本题考查化学平衡的计算,涉及反应速率的计算、转化率的计算、反应速率及平衡移动的影响因素,综合性较强,注重高考常考考点的考查,题目难度中等.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液其PH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
将0.4 g NaOH和1.06 g Na2CO3 混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
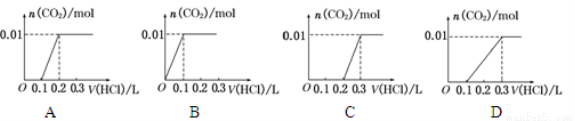
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度℃ | 450 | 500 | 550 | 600 |
| SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进入地下矿井中可用火把照明 | |
| B. | 实验时将水倒入浓硫酸中配置稀硫酸 | |
| C. | 节日期间,在开阔的广场燃放烟花爆竹 | |
| D. | 在实验室可以用手接触药品,用嘴吹灭酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com