
| A、根据金属活动性顺序表,可以推断冶炼金属时可能的方法 |
| B、CaCl2、MgCl2晶体都容易潮解,它们潮解的实质是晶体表面吸水形成溶液 |
| C、根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量 |
| D、根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行 |


科目:高中化学 来源: 题型:
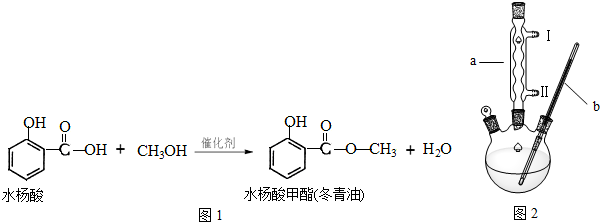
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu(NO3)2 |
| B、K2SO4 |
| C、HCl |
| D、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中C(H+)≠C(OH-) |
| B、100℃时,Na2CO3溶液中KW=1×10-14 |
| C、100℃时,0.1 mol?L-1NaOH溶液pH=11 |
| D、100℃时,0.1 mol?L-1H2SO4溶液中,水电离产生C(H+)=1.0×10-11mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分类回收垃圾 |
| B、举行地球一小时熄灯活动 |
| C、大力发展火力发电厂 |
| D、大规模开展植树造林、退耕还林还草等工作 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-Ba2+NO3-K+ |
| B、Na+ SO42- Cu2+ Cl- |
| C、HCO3- Cl- Na+ Ba2+ |
| D、Fe3+ Al3+ I- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中c(H+)=c(Cl-) |
| B、与等体积pH=12的氨水混合后所得溶液显酸性 |
| C、由HCl电离出的H+约为由H2O电离出H+浓度的1010倍 |
| D、与等体积O.01 mol?L-1碳酸钠溶液混合后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 14 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com