
����Ŀ��������ѧ֪ʶ�ش���������:
��1��A��NaOH��Һ��Ӧ��������ת����ϵ(����������ˮ������ʡ�ԣ�δ��ʾ����)��
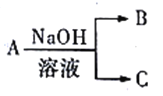
����AΪ�����������ʣ�CΪ���壬д����B��Һ��ͨ�����CO2��Ӧ�����ӷ���ʽ:_______________��
����AΪ�����ijɷ�֮һ�����������ЧӦ������100mL1mol/LNaOH��Һ��ͨ��1.344L����(��״����)��ַ�Ӧ������B��C�����ʵ���֮��Ϊ______(B��Ħ����������C)��
����AΪAlCl3��д��A��NaOH�����ʵ���֮��3:10���ʱ������Ӧ�����ӷ���ʽ:______________��
��2���Ȼ�����Һ�����ڸ�ʴӡˢͭ��·�壬��д����ص����ӷ���ʽ: ______________����μ�����Һ�е��������Ѿ���ȫ��Ӧ: ______________��
��3������AlCl3��FeCl3�����Һ,����A13+��Fe3+�����ʵ���֮��Ϊ0.1mol�������Һ�м���80mLŨ��Ϊ4mol/L��NaOH��Һ��ʹ���ַ�Ӧ����ԭ�����Һ��A13+�����ʵ�����A13+��Fe3+�������ʵ����ı�ֵΪx�����������ɵij�����ֻ��Fe(OH)3ʱ��x��ȡֵ��Χ��______������ͼ�л�����������(mol)��x(0��1.0)�仯������:______________
���𰸡� AlO2-+CO2+2H2O=HCO3-+Al(OH)3�� 2:1 3A13++10OH-=2Al(OH)3��+AlO2-+2H2O Cu+2Fe3+=2Fe2++Cu2+ ȡ�����μ�1~2�����軯����Һ����Һ����죬���������Ѿ���ȫ��Ӧ 0<x��0.2 
��������(1)����AΪ�����������ʣ���AΪ����CΪ���壬CΪ������BΪƫ�����ƣ���ƫ��������Һ��ͨ�����CO2��Ӧ������������������̼�����ƣ���Ӧ�����ӷ���ʽΪAlO2-+CO2+2H2O=HCO3-+Al(OH)3�����ʴ�Ϊ��AlO2-+CO2+2H2O=HCO3-+Al(OH)3����
����AΪ�����ijɷ�֮һ�����������ЧӦ����AΪ������̼��100mL1mol/LNaOH��Һ�к�����������0.1mol����״����1.344L������̼�����ʵ���Ϊ![]() =0.06mol���������ɵ�̼����Ϊxmol��̼������Ϊymol������̼ԭ���غ����ԭ���غ���x+y=0.06mol��2x+y=0.1mol�����x=0.04��y=0.02��B��Ħ����������C����BΪ̼���ƣ�CΪ̼�����ƣ�B��C�����ʵ���֮��=0.04mol��0.02mol=2:1���ʴ�Ϊ��2:1��
=0.06mol���������ɵ�̼����Ϊxmol��̼������Ϊymol������̼ԭ���غ����ԭ���غ���x+y=0.06mol��2x+y=0.1mol�����x=0.04��y=0.02��B��Ħ����������C����BΪ̼���ƣ�CΪ̼�����ƣ�B��C�����ʵ���֮��=0.04mol��0.02mol=2:1���ʴ�Ϊ��2:1��
����AΪAlCl3���Ȼ�������NaOH�����ʵ���֮��3:10���ʱ������������������ƫ�����ƣ���Ӧ�����ӷ���ʽΪ3A13++10OH-=2Al(OH)3��+AlO2-+2H2O���ʴ�Ϊ��3A13++10OH-=2Al(OH)3��+AlO2-+2H2O��
(2)�Ȼ�����ͭ����������ԭ��Ӧ�������Ȼ��������Ȼ�ͭ����Ӧ�����ӷ���ʽΪCu+2Fe3+=2Fe2++Cu2+��Ҫ֤����Һ�е��������Ѿ���ȫ��Ӧ��ֻ��Ҫ֤����Һ��û�������Ӽ��ɣ�������ȡ�����μ�1~2�����軯����Һ����Һ����죬���������Ѿ���ȫ��Ӧ���ʴ�Ϊ��Cu+2Fe3+=2Fe2++Cu2+��ȡ�����μ�1~2�����軯����Һ����Һ����죬���������Ѿ���ȫ��Ӧ��
(3)80mL 4mol/L��NaOH��Һ�к�����������0.32mol��Fe3+�����ʵ���Ϊ0.1mol��(1-x)�����ĵ�OH-���ʵ���Ϊ0.1mol��(1-x)��3��Fe3+��Ӧ��ʣ���OH-���ʵ���Ϊ0.32mol-0.1mol��(1-x)��3����������Al(OH)3����0.32mol-0.1mol��(1-x)��3��0.1mol��x��4�����x��0.2����0��x��0.2����0��x��0.2ʱ������ֻ��Fe(OH)3��Fe(OH)3������Ϊ0.1mol��(1-x)=0.1mol-0.1xmol��0.2��x��1ʱ����������Ϊ��0.1mol��(1-x)+0.1mol��x-(0.32mol-0.1mol��3)=0.08mol��
�ʳ�������(mol)��x(0��1.0)�仯������Ϊ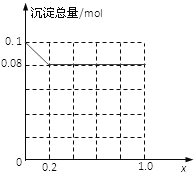 ���ʴ�Ϊ��0��x��0.2��
���ʴ�Ϊ��0��x��0.2�� ��
��


 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ɷ��Ǹ��л�ѧѧϰ���õķ���֮һ��ij��ѧ�о���ѧϰС����ѧϰ�ˡ���ѧ��Ӧԭ���������������µĹ����ܽ������ȷ���ǣ� �� �ٳ����£�pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������ϣ�����c��Na+��+c��H+��=c��OH����+c��CH3COO����
�ڶ��ѽ�����ѧƽ���ij���淴Ӧ�����ı�����ʹ��ѧƽ��������Ӧ�����ƶ�ʱ��������İٷֺ���һ������
�۳����£�AgCl��ͬ���ʵ���Ũ�ȵ�CaCl2��NaCl��Һ�е��ܽ����ͬ
�ܳ����£���֪�������ƽ�ⳣ��ΪKa�������ˮ��ƽ�ⳣ��ΪKh��ˮ�����ӻ�ΪKw��KaKh=Kw
�ݵ�⾫��ͭʱ���������Һ��ͭ����Ũ�Ȳ��䣮
A.�٢�
B.�٢ڢ�
C.�٢ڢܢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ºϳ�·�ߣ�������ת��Ϊ���� 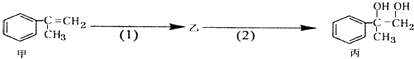
��������������ǣ� ��
A.�ͱ�����������KMnO4��Һ������Ӧ
B.��Ӧ��1�������Լ���Һ�壬��������
C.���裨2�������п��ܺ���δ��Ӧ�ļף�������ˮ�����Ƿ�
D.��Ӧ��2����Ӧ����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬ��Ba(OH)2��Һ�У��ֱ�������ʵ���Ũ����ȵ�H2SO4��NaHSO4��Һ���䵼�������������Һ����仯����������ͼ��ʾ�����з�������ȷ���ǣ� ��

A. �ٴ����μ�H2SO4��Һ�ı仯����
B. b�㣬��Һ�д������ڵ�������Na+��OH�C
C. c�㣬����Һ�к�����ͬ����OH�C
D. a��d�����Ӧ����Һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ͷ�չ����Ҫ���ʻ������л��߷��Ӳ��ϵij����Dz��Ϸ�չʷ�ϵ�һ���ش�ͻ�ƣ��¸������к����л��߷��Ӳ��ϵ��ǣ� ��
A.��ͨˮ��
B.��ͨ����
C.������̥
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ʵ����ģ����ͼ��ʾ�����ڸ����ʵ�˵����ȷ���ǣ� �� 
A.�����ʵĽṹ��ʽΪ 
B.�����ʿ��Է����ӳɷ�Ӧ
C.�����ʼȿ�����ǿ�ᷴӦ������������ǿ�Ӧ
D.�����ʲ����Ծۺϳɸ߷�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������CO2����ͨ��NaOH��Ca (OH)2��NaAlO2�Ļ����Һ�У������ɳ��������ʵ�����ͨ��CO2������Ĺ�ϵ�ɱ�ʾΪ

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ������������ǣ� �� 
A.ͼ1��ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ241.8 kJmol��1
B.ͼ2��ʾѹǿ�Կ��淴Ӧ2A��g��+2 B��g��3C��g��+D��s����Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
C.ͼ3��ʾ�������ļء��Ʒֱ�������ˮ��Ӧ�����Ϊ��
D.ͼ4��ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯������ͬ������NaA��Һ��pH����ͬŨ�ȵ�NaB��Һ��pH
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com