
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;Ca的最外层电子数为2.
;Ca的最外层电子数为2.分析 (1)稀有气体原子最外层为稳定结构,化学性质最不活泼;
(2)N原子质子数为7,核外电子数为7,有2个电子层,各层电子数为2、5;
Ca处于第四周期ⅡA族,主族元素最外层电子数=族序数;
(3)同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性增强;
(4)同周期自左而右原子半径减小;
(5)同周期自左而右非金属性增强,氢化物稳定性增强;
(6)硅是良好的半导体材料;
(7)海水中含有的盐主要为NaCl,含有钠元素,焰色反应为黄色,因含有氯化镁而潮解;
(8)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水.
解答 解:(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,故答案为:氩;
(2)N原子质子数为7,核外电子数为7,有2个电子层,各层电子数为2、5,原子结构示意图为 ;Ca处于第四周期ⅡA族,最外层电子数为2,故答案为:
;Ca处于第四周期ⅡA族,最外层电子数为2,故答案为: ;2;
;2;
(3)同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性增强,故酸性最强的为HClO4,故答案为:HClO4;
(4)同周期自左而右原子半径减小,故原子半径O<N<C,故答案为:O<N<C;
(5)同周期自左而右非金属性增强,氢化物稳定性增强,上述元素氢化物中H2O最稳定,故答案为:H2O;
(6)晶体硅的主要用途是:集成电路、半导体等,故答案为:集成电路、半导体等;
硅是良好的半导体材料;
(7)从海水中可以提取的第一大类物质是NaCl,该物质的焰色反应为黄色,它暴露在空气中易潮解是因为还含有MgCl2,
故答案为:NaCl;黄;MgCl2;
(8)Na、Al最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3=NaAlO2+2H2O.
点评 本题考查元素周期表与元素周期律综合应用,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
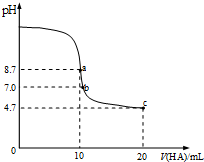 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA) | B. | a、c两点溶液中水的电离程度相同 | ||
| C. | b点溶液中:c(Na+)=c(A-)+c(HA) | D. | c点溶液中:c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
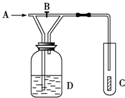 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | H2O | D. | 饱和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 官能团 | 选择试剂 | 实验现象 | 有关反应的化学方程式或离子方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
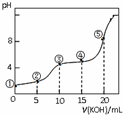 常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )| A. | 点②溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| B. | 点③溶液中:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) | |
| C. | 点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05 mol•L-1 | |
| D. | 点⑤溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com