
下列叙述正确的是
A.电解饱和食盐水能制得NaOH
B.澄清石灰水能鉴别Na2CO3和NaHCO3
C.配制溶液,定容时俯视容量瓶刻度会使溶液浓度偏低
D.铁粉中混入少量铝粉,可加入过量的氨水后过滤除去
A
【解析】
试题分析:A.电解饱和食盐水,反应方程式是:2NaCl+2H2O Cl2↑+H2↑+2NaOH,因此能制得NaOH,正确;B.澄清石灰水的溶质Ca(OH)2与Na2CO3和NaHCO3都能发生反应产生CaCO3不是沉淀,因此不能鉴别Na2CO3和NaHCO3,错误;C.配制溶液,定容时俯视容量瓶刻度,则溶液的体积偏小,由于溶质的物质的量不变,所以会使溶液浓度偏高,错误;D.Al可以与强酸、强碱反应,而氨水中的一水合氨是弱碱,不能与Al发生反应,所以铁粉中混入少量铝粉,不可加入过量的氨水后过滤除去,错误。
Cl2↑+H2↑+2NaOH,因此能制得NaOH,正确;B.澄清石灰水的溶质Ca(OH)2与Na2CO3和NaHCO3都能发生反应产生CaCO3不是沉淀,因此不能鉴别Na2CO3和NaHCO3,错误;C.配制溶液,定容时俯视容量瓶刻度,则溶液的体积偏小,由于溶质的物质的量不变,所以会使溶液浓度偏高,错误;D.Al可以与强酸、强碱反应,而氨水中的一水合氨是弱碱,不能与Al发生反应,所以铁粉中混入少量铝粉,不可加入过量的氨水后过滤除去,错误。
考点:考查物质的制取方法、物质的鉴别、除杂及溶液配制的误差分析的知识。
考点分析: 考点1:元素及其化合物的综合运用 试题属性

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源:2014-2015学年北京市丰台区高三一模理综化学试卷(解析版) 题型:实验题
(15分)氧化亚铜是大型水面舰艇防护涂层的重要原料。某小组通过查阅资料,进行如下研究。

I.Cu2O的制取
(1)葡萄糖还原法制Cu2O的化学方程式为 。
(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要 。
II.检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸。
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质。乙同学认为此推论不合理,用化学用语解释原因 。
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是 。
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜。
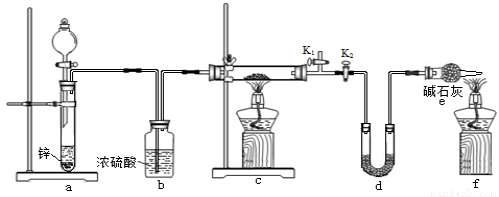
(5)装置a中所加的酸是 (填化学式),装置e中碱石灰的作用是 。
(6)点燃装置c中酒精灯之前需进行的操作是 。
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:选择题
下列关于阿佛加德罗常数的说法正确的是
A.0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2
B.一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA
C.常温下18 g铝放入足量浓硫酸中转移电子数2 NA
D.1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:选择题
下列选项中哪一种可与陶瓷、普通玻璃、水泥归为同种类型的材料
A.铝合金 B.高温结构氮化硅陶瓷
C.有机玻璃 D.砖瓦
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:填空题
(16分)Suzuki偶联反应在有机合成上有广泛应用。反应①如下(Ph-代表苯基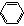 ─):
─):
反应①: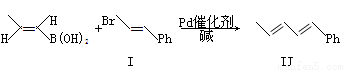
化合物I可以由以下途径合成:
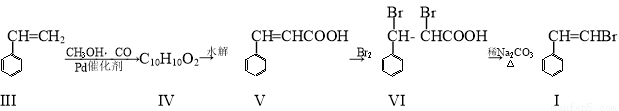
(1)化合物V的分子式为 ;1mol化合物I最多可跟 mol氢气反应。
(2)化合物IV的结构简式为 ;化合物V转化为化合物VI的反应类型为 。
(3)写出化合物VI在NaOH溶液中共热的反应方程式 。
(4)已知化合物Ⅶ是化合物V的同分异构体,其苯环上一溴代物有2种,且1mol Ⅶ与足量银氨溶液反应生成4mol Ag,写出化合物Ⅶ的一种结构简式 。
(5)化合物(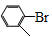 )与化合物【(HO)2B─
)与化合物【(HO)2B─ ─COOH】也能发生类似反应①的偶联反应,写出产物的结构简式 。
─COOH】也能发生类似反应①的偶联反应,写出产物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
(16分)以黄铜矿为主要原料来生产铜、铁红颜料和硫单质,原料的综合利用率较高。其主要流程如下:

回答下面问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是要消耗大量的热能以及 (完成合理的一种即可)。
(2)过滤③得到的滤渣成分是 (填化学式)。
(3)反应Ⅰ~Ⅴ中,共有 个反应不属于氧化还原反应。
(4)溶液A中含有的溶质是 (填化学式)。
(5)写出反应Ⅰ的化学方程式 。
(6)①反应Ⅲ是FeCO3在空气中煅烧,写出化学方程式 。
②反应Ⅳ中发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.乙醇与乙酸都存在碳氧双键
B.油脂水解可得到氨基酸和甘油
C.淀粉和纤维素水解最终产物都是葡萄糖
D.卤代烃加入硝酸酸化的硝酸银溶液可根据生成的卤化银沉淀颜色检验卤原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:填空题
(16分)磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式: 。
②n越大,直链聚磷酸铵的水溶性越 (填“大”或“小”)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
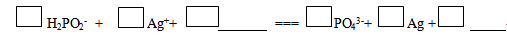
(3)由工业白磷 (含少量砷、铁、镁等) 制备高纯白磷 ( 熔点44℃,沸点280℃),主要生产流程如下:
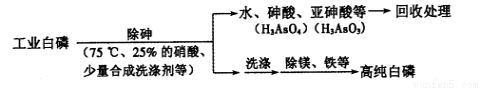
①除砷过程在75 ℃下进行,其合理的原因是 (填字母)。
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是 。
③除砷过程中,合成洗涤剂起到 作用。
④硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式: 。
氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越 (填“多”或“少”)。
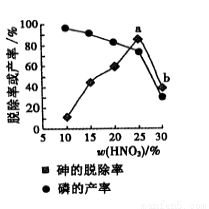
⑤某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图,砷的脱除率从a点到b点降低的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:选择题
下列有关原子结构、元素性质的说法正确的是
A.Si、P、S、Cl元素的单质与氢气化合越来越容易
B.元素原子最外层电子数越多,元素金属性越强
C.元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族
D.F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com