
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如图:
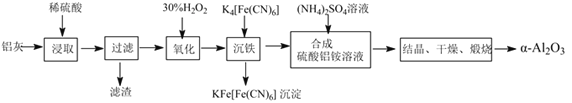
(1)铝灰中氧化铝与硫酸反应的化学方程式为___。
(2)图中“滤渣”的主要成分为___(填化学式)。加30%的H2O2溶液发生的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为___。
(4)煅烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是___(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有__(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为___。
【答案】Al2O3+3H2SO4=Al2(SO4)3+3H2O SiO2 静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。或加KSCN溶液 N2 SO3、NH3 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
【解析】
铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),加入稀硫酸浸取,只有SiO2不溶而成为滤渣;加入30%H2O2,将Fe2+氧化为Fe3+,加入K4[Fe(CN)6]溶液,生成KFe[Fe(CN)6]蓝色沉淀;加入(NH4)2SO4,Al3+转化为NH4Al(SO4)2,再蒸发结晶,便可获得[NH4Al(SO4)2·12H2O,煅烧后得到![]() -Al2O3。
-Al2O3。
(1)铝灰中氧化铝与硫酸反应生成硫酸铝和水,化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O。答案为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2)由以上分析可知,图中“滤渣”的主要成分为SiO2。答案为:SiO2;
(3)验证“沉铁”后,溶液中是否还含有铁离子,可使用K4[Fe(CN)6]溶液检验,操作方法为静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。或加KSCN溶液,观察溶液是否变为血红色;答案为:静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。或加KSCN溶液;
(4)煅烧后,所得气体为NH3、N2、SO3、SO2,通过NaHSO3溶液,可吸收SO3和NH3;通过KMnO4溶液,可吸收SO2,最后剩余N2和水蒸气,用排水法收集,气体主要为N2。
①集气瓶中收集到的气体是N2。答案为:N2;
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有SO3、NH3。答案为:SO3、NH3;
③KMnO4溶液褪色(MnO4-还原为Mn2+),则MnO4-与SO2反应生成Mn2+、SO42-等,发生的离子反应方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成![]() ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
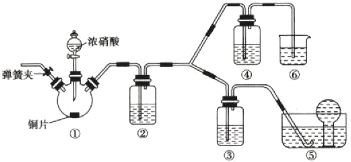
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与![]() 反应:
反应:![]() 。
。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______________________________________。
(2)滴加浓硝酸之前的操作是检查装置的气密性,加入药品,打开弹簧夹后_______________________________________。
(3)装置①中发生反应的化学方程式是____________________________________________。
(4)装置②的作用是_____________________,发生反应的化学方程式是________________________________________。
(5)该小组得出的结论所依据的实验现象是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松油醇具有紫丁香味,其酯类常用于香精调制。下图为松油醇的结构,以下关于它的说法正确的是
![]()
A. 分子式为C10H19O
B. 同分异构体可能属于醛类、酮类或酚类
C. 与氢气加成后的产物有4种一氯代物
D. 能发生取代、氧化、还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子,属于同种核素的是_____(填编号,下同),互为同位素的是______,互为同素异形体的是_____,属于同种物质的是_________。
①16O2和18O3②16O2和18O2③ H、D、T ④![]() 和
和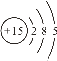 (核内15个中子)
(核内15个中子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率Al-H2O2动力电池(如图),下列说法不正确的是
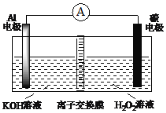
A. H2O2 在碳电极上发生还原反应
B. 碳电极附近溶液的pH增大
C. 溶液中OH-向负极移动
D. 负极反应式为Al-3e-+3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用粗制ZnO粉末(含杂质Fe、Ni等)制备高纯ZnO的流程如下:
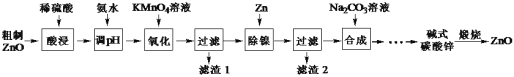
已知:本实验条件下,Ni2+不能被氧化,高锰酸钾还原产物为MnO2
(1)加快酸浸速率可采取的措施______。(任举一条)
(2)调pH约为5,再加KMnO4溶液进行氧化。写出“氧化”步骤对应的离子方程式______。
(3)“滤渣2”的成分是______。
(4)流程中“![]() ”涉及的操作有______、洗涤、______。
”涉及的操作有______、洗涤、______。
(5)获得的碱式碳酸锌需要用水洗涤,检验沉淀是否洗涤干净的方法是_____。
(6)已知Ksp[Fe(OH)3]=2.6×10-39。 25℃时,调节某酸性废水的pH值,使溶液中的Fe3+残留浓度为2.6×10-6molL-1,则pH应调至______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如图所示:
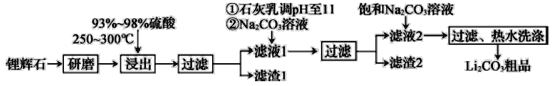
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2+H2SO4(浓)![]() Li2SO4+Al2O3·4SiO2·H2O。
Li2SO4+Al2O3·4SiO2·H2O。
③某些物质的溶解度(S)如下表所示:
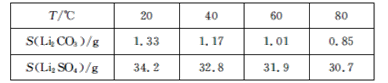
回答下列问题:
(1)从滤渣1中分离出Al2O3的流程如下所示:
![]()
写出生成沉淀的离子方程式:___。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是___(运用化学平衡原理简述)。
(3)最后一个步骤中,用“热水洗涤”的理由是___。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中电解时所用的是___(填“阳离子交换膜”或“阴离子交换膜”)。
②电解后,LiOH溶液浓度增大的原因是___。
b中生成Li2CO3反应的化学方程式是___。
(5)磷酸亚铁锂电池总反应为FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,写出该电池放电时的正极反应:___。
LiFePO4,电池中的固体电解质可传导Li+,写出该电池放电时的正极反应:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D的结构简式如图所示。
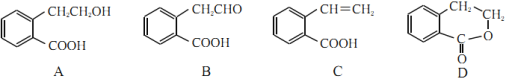
(1)A、B、C中含有的相同官能团名称是___________。
(2)在A、B、C、D中,1mol物质与足量钠反应产生1molH2的是___________(填字母)。
(3)A→B的反应类型是___________;A、B、C、D中互为同分异构体的是___________(填字母)。
(4)A发生缩聚反应的产物的结构简式为___________;C发生加聚反应的产物的结构简式为___________。
(5)写出由A→C的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com