

 .
. .
.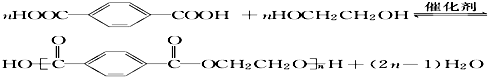 .
.分析 D和C反应生成甲醇和DAP树脂单体,根据题给信息知,D、C两种物质一种是醇、一种是酯,根据流程图知,A、D中含有苯环,D的结构简式为 ,C是CH2=CHCH2OH,H与甲醇发生酯化反应生成D,所以H为
,C是CH2=CHCH2OH,H与甲醇发生酯化反应生成D,所以H为 ,A被酸性高锰酸钾氧化生成H,则A结构简式为
,A被酸性高锰酸钾氧化生成H,则A结构简式为 ,苯和丙烯发生加成反应生成E,E为A的同分异构体,其两个相同的支链上核磁共振氢谱共有2个信号峰,所以其结构简式为
,苯和丙烯发生加成反应生成E,E为A的同分异构体,其两个相同的支链上核磁共振氢谱共有2个信号峰,所以其结构简式为 ,B和甲醇反应生成丙烯醇和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2,再结合题目分析解答.
,B和甲醇反应生成丙烯醇和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2,再结合题目分析解答.
解答 解:D和C反应生成甲醇和DAP树脂单体,根据题给信息知,D、C两种物质一种是醇、一种是酯,根据流程图知,A、D中含有苯环,D的结构简式为 ,C是CH2=CHCH2OH,H与甲醇发生酯化反应生成D,所以H为
,C是CH2=CHCH2OH,H与甲醇发生酯化反应生成D,所以H为 ,A被酸性高锰酸钾氧化生成H,则A结构简式为
,A被酸性高锰酸钾氧化生成H,则A结构简式为 ,苯和丙烯发生加成反应生成E,E为A的同分异构体,其两个相同的支链上核磁共振氢谱共有2个信号峰,所以其结构简式为
,苯和丙烯发生加成反应生成E,E为A的同分异构体,其两个相同的支链上核磁共振氢谱共有2个信号峰,所以其结构简式为 ,B和甲醇反应生成丙烯醇和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2,
,B和甲醇反应生成丙烯醇和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2,
(1)根据上面的分析可知在,H为 ,H中含氧官能团的名称是羧基,反应②的反应类型为酯化(取代)反应,
,H中含氧官能团的名称是羧基,反应②的反应类型为酯化(取代)反应,
故答案为:羧基;酯化(取代);
(2)根据上面的分析可知在,E为 ,
,
故答案为: ;
;
(3)反应④的化学方程式 为 ,
,
故答案为: ;
;
(4)D的结构简式为 ,D的同分异构体F苯环上只有两个相同的取代基,且能与NaOH溶液反应,说明有酯基或羧基,这样的结构可以是苯环连有两个-COOCH3,或两个-CH2COOH,或两个-OOCH2CH3,或两-CH2OOCH,它们各有邻间对三种位置关系,所以F的结构共有11种(不包括D),
,D的同分异构体F苯环上只有两个相同的取代基,且能与NaOH溶液反应,说明有酯基或羧基,这样的结构可以是苯环连有两个-COOCH3,或两个-CH2COOH,或两个-OOCH2CH3,或两-CH2OOCH,它们各有邻间对三种位置关系,所以F的结构共有11种(不包括D),
故答案为:11;
(5)对苯二甲酸与乙二醇发生缩聚反应的方程式为 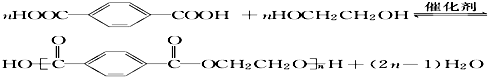 ,
,
故答案为: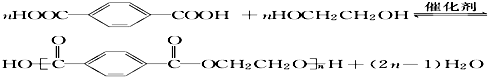 ;
;
(6)丙烯和氧气、乙酸反应生成乙酸丙烯酯,乙酸丙烯酯和溴发生加成反应生成CH3COOCH2CHBrCH2Br,CH3COOCH2CHBrCH2Br在加热条件下和氢氧化钠的水溶液发生取代反应生成甘油,然后发生硝化反应生成硝化甘油,其流程图为 ,
,
答: .
.
点评 本题考查有机物的推断和合成,明确有机物中官能团及其性质是解本题关键,以DAP单体为突破口采用逆向方法进行推断,注意结合题给信息进行推断,同时考查学生灵活运用知识解答问题能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据其结构判断该含氧酸为强酸 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线形非极性分子 | D. | 该分子的电子式是H:O:Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
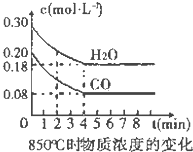 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
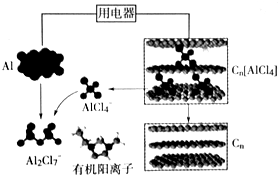
| A. | 充电时,Al做阴极、Cn为阳极 | |
| B. | 充电时,每生成1mol铝,同时消耗4molAl2Cl7- | |
| C. | 放电时,电解质中的有机阳离子向铝电极方向移动 | |
| D. | 放电时,正极反应式为Cn[AlCl4]+e-=Cn+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
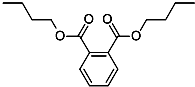 今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(
今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(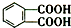 )与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
)与正丁醇发生酯化反应制得,下列有关说法不正确的是( )| A. | 邻苯二甲酸二丁酯(DBP)分子式为:C16H22O4 | |
| B. | 邻苯二甲酸二丁酯(DBP)苯环上的一氯代物有4种 | |
| C. | 邻苯二甲酸二丁酯(DBP)属于乙酸乙酯的同系物 | |
| D. | 丁醇有4种不同结构,所以戊醛也有4种不同结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com