
| A. | Cl2>Fe3+>I2>S | B. | S>I2>Fe3+>Cl2 | C. | Fe3+>Cl2>H2S>I2 | D. | Cl2>I2>Fe3+>H2S |
分析 氧化还原反应中含有元素化合价降低的物质为氧化剂,通过氧化反应得到的产物为氧化产物,根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性来解答.
解答 解:①反应H2S+I2═S↓+2HI,氧化剂为I2,氧化产物为S,所以氧化性I2>S;
③2FeCl2+Cl2═2FeCl3,氧化剂为Cl2,氧化产物为FeCl3,所以氧化性Cl2>FeCl3;
②2FeCl3+2HI═I2+2FeCl2+2HCl,氧化剂为FeCl3,氧化产物为I2,所以氧化性FeCl3>I2;
所以氧化性Cl2>FeCl3>I2>S.
故选A.
点评 本题考查了根据方程式来比较氧化性和还原性,解题的关键是根据化合价找出氧化剂、还原剂、氧化产物和还原产物,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3的热稳定性比NaHCO3强 | |
| B. | 相同温度时,Na2CO3 的溶解度大于NaHCO3 的溶解度 | |
| C. | Na2CO3 和NaHCO3都能和稀盐酸反应产生CO2 气体 | |
| D. | NaHCO3 一定条件下可转化为Na2CO3,但Na2CO3 不能转化为NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn | |
| C. | 若两电极都是金属,则它们的活动性为X>Y | |
| D. | X极上发生的是还原反应,Y极上发生的氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
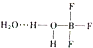 硼元素在化学中很重要的地位,硼及其化合物广泛应用于水磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用.
硼元素在化学中很重要的地位,硼及其化合物广泛应用于水磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com