
【题目】向2l恒温恒容容器中加入2molMgSO4并充入 2molCO,发生反应:MgSO4(s)+ CO(g)![]() MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
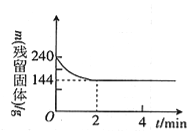
A. 0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1 ·min-1
B. 2 ~4min内容器内气体的密度没有变化
C. 该温度下,反应的平衡常数为1.8
D. 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)> 0.60 mol
【答案】C
【解析】因为1mol硫酸镁变为氧化镁,质量减少80g。由图像可知,反应在2min达到平衡状态,固体的质量由240g变为144g,减少了96g,所以硫酸镁消耗了即减少了1.2mol,所以CO也要减少1.2mol、剩余0.8mol,CO2和SO2都生成了1.2mol。A. 0 ~2min内平均反应速率v(SO2)= ![]() 0.3mol·l-1 ·min-1,A正确;B. 2 ~4min内,反应处于化学平衡状态,容器内气体的密度没有变化,B正确;C. 该温度下,反应的平衡常数为
0.3mol·l-1 ·min-1,A正确;B. 2 ~4min内,反应处于化学平衡状态,容器内气体的密度没有变化,B正确;C. 该温度下,反应的平衡常数为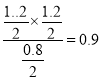 ,C不正确;D. 保持其他条件不变,起始时向1L容器中充入1.00 mol MgSO4和1.00 mol CO,反应达到平衡时与题中的平衡等效,可以求出n(CO2)= 0.6 mol。在此基础上,减小压强,把容器体积扩大到2L,则平衡向正反应方向移动,所以n(CO2)> 0.60 mol,D正确。本题选C。
,C不正确;D. 保持其他条件不变,起始时向1L容器中充入1.00 mol MgSO4和1.00 mol CO,反应达到平衡时与题中的平衡等效,可以求出n(CO2)= 0.6 mol。在此基础上,减小压强,把容器体积扩大到2L,则平衡向正反应方向移动,所以n(CO2)> 0.60 mol,D正确。本题选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有一份气体样品的质量是14.2 g,体积是4.48 L(标准状况下),该气体的摩尔质量是
A. 28.4 g B. 28.4 g·mol-1 C. 71 g·mol-1 D. 14.2 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号的物质为杂质)的方法中,错误的是( )
A. FeCl3溶液(FeCl2):通入适量Cl2
B. CO(CO2):通过NaOH溶液洗气后干燥
C. Fe2O3(Al2O3):加入足量NaOH溶液
D. CO2(HCl):通过饱和Na2CO3溶液洗气后干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
① Al2O3 ② Cu(OH)2 ③ Al(OH)3 ④ Na2CO3 ⑤ NaHCO3
A. ①②⑤ B. ②④ C. ①②④ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是
A. v(A)=0.15 mol/(L·min) B. v(B)=0.6 mol/(L·min)
C. v(C)=0.4 mol/(L·min) D. v(D)=0.8 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a g钠、铝的混合物,放入b g水中,反应停止后得到的沉淀有c g,则溶液中溶质为( )
A. NaOH B. NaAlO2 C. NaOH和NaAlO2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,下图所示是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程。
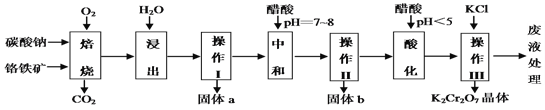
已知1:物质的溶解度(g/100g水)
物质 | 0℃ | 40℃ | 80℃ |
KCl | 28.0 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38.0 |
K2Cr2O7 | 4.7 | 26.3 | 73.0 |
Na2Cr2O7 | 163.0 | 215.0 | 376.0 |
已知2:①焙烧时有Na2CrO4、 Fe2O3 、NaAlO2 等生成。
②Cr2O72- + H2O ![]() 2CrO42- + 2H+ ;
2CrO42- + 2H+ ;
③Cr2O72-具有很强的氧化性
回答问题:
(1)“浸出”步骤中,为了提高浸出率,可采取的措施有加热、研磨或_______________等(要求写一条)。
(2)固体b中主要含有______________________(填写化学式)。
(3)要检测酸化操作中溶液的pH是否等于4.5,应该使用_______(填写仪器或用品名称)。
(4)酸化步骤用醋酸调节溶液的pH﹤5,其目的是____________________;不用盐酸调节溶液pH的原因是______________________________________。
(5)操作III发生反应的化学方程式是____________________________ ;
(6)写出焙烧时生成NaAlO2的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:①2Na+2H2O═2NaOH+H2↑ ②2F2+2H2O═4HF+O2③Cl2+H2O═HCl+HClO④2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑⑤CaO+H2O═Ca(OH)2⑥CaCO3+H2O+CO2═Ca(HCO3)2
2NaOH+H2↑+Cl2↑⑤CaO+H2O═Ca(OH)2⑥CaCO3+H2O+CO2═Ca(HCO3)2
(1)其中水在反应中作氧化剂的反应是(填代号下同) .
(2)其中水在反应中作还原剂的反应是 .
(3)其中水在反应中既不作氧化剂也不作还原剂的反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。
已知:①亚氯酸钠(NaClO2)受热易分解。
②NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
③纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
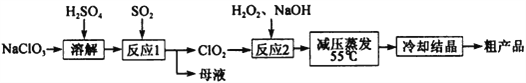
(1)“反应1”需要鼓入空气,空气的作用是 __________________________________。
(2)“反应2”的化学方程式为_________________________________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是___________________;结晶后需要对晶体洗涤,为了减少损失,可以用_____________ 洗涤晶体。
(4)从“母液”中可回收的主要物质是_____________ 。
(5)要得到纯的亚氯酸钠晶体(NaClO2·3H2O),对粗产品必须进行的操作为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com