

分析 海水结晶得到粗盐,除去钙离子选用碳酸钠溶液、除去镁离子选用氢氧化钠溶液、除去硫酸根离子选用氯化钡溶液,为了保证将杂质除尽,所加试剂必须过量,为了不引进新的杂质,后面加入的试剂要能够除去前面所加入的过量试剂,饱和食盐水电解得到氯气、氢气和氢氧化钠,母液加入石灰乳沉镁离子生成氢氧化镁沉淀过滤后的测定中加入盐酸生成氯化镁溶液,浓缩结晶得到氯化镁晶体,氯化氢气流中失水得到氯化镁,电解熔融氯化镁得到镁和氯气;
Ⅰ.加碳酸钠要放在加氯化钡之后,可以同时除去过量的钡离子,工业食盐中含有较多的Ca2+、Mg2+杂质,可以用试剂NaOH、Na2CO3除去,所以离子反应式为Ca2++CO32-=CaCO3↓,Mg2++2OH-=Mg(OH)2↓,如果含有SO42-,则可加Ba2+形成BaSO4白色沉淀;由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2;为了有效除去Mg2+、Ca2+和SO42-,必须先加钡试剂或NaOH,最后加入Na2CO3溶液,如果先加入Na2CO3溶液,后加BaCl2或Ba(OH)2,则多余Ba2+无法除去;
Ⅱ.用Ca(OH)2制取氢氧化镁,是氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,原料为海水,应减少交通费用,为避免污染,应远离景区和居民区.
解答 解:Ⅰ.有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项BC符合,
除去粗盐中的SO42-,可加Ba2+形成BaSO4白色沉淀,由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2,故AC正确,
故答案为:BC; AC;
Ⅱ.用Ca(OH)2制取氢氧化镁,是氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,从经济效益角度看,原料为海水,应减少交通费用,该化工厂的厂址应选择在在海岸附近,为避免污染,应远离景区和居民区,
故答案为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;远离景区、居民区的海岸附近.
点评 本题考查了海水资源及其综合应用,题目难度中等,注意掌握化学实验基本操作方法,明确物质分离与提纯方法,特别是除杂试剂的加入顺序,试题培养了学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液 | |
| B. | 某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 | |
| C. | 用过滤法无法除去Fe(OH)3胶体中的FeCl3 | |
| D. | 升高温度纯水的离子积增大,但pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制硫酸亚铁溶液时,通常在溶液中加入少量的稀硫酸和铁 | |
| B. | 向BaCl2溶液中滴加稀硫酸的过程中,溶液的导电能力不变 | |
| C. | 向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO32- | |
| D. | 把SO2通入盛有滴加了酚酞的NaOH溶液中,溶液褪色,说明SO2有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol C2H2(g)完全燃烧生成气态水时放热大于2600kJ | |
| B. | 2mol C6H6(1)完全燃烧生成液态水时放热大于6590kJ | |
| C. | 相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 | |
| D. | C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
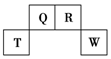 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等. .用化学方程式表示工业常用冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
.用化学方程式表示工业常用冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
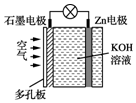
| A. | 电池放电时Zn电极逐渐溶解 | |
| B. | 石墨为正极 | |
| C. | 电子由石墨经导线流向Zn片 | |
| D. | 电池放电时实现了化学能向电能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com