
分析 滴定操作时,滴定管必须使用待装液润洗,锥形瓶不能润洗;滴定时眼睛应该注视锥形瓶中混合液颜色变化;滴定终点现象为溶液由无色变成粉红色且半分钟不褪色;滴定管读数应该读到0.01mL.
解答 解:(3)加入待测的NaOH溶液,碱式滴定管用蒸馏水洗完,必须使用待装液润洗,才能量取氢氧化钠溶液,故(3)错误;
(10)边注视滴定管内液面变化,该操作错误,滴定时眼睛应该注视锥形瓶中溶液颜色变化,以便及时判断达到终点,故(10)错误;
(11)当小心滴到溶液由无色变成粉红色且半分钟不褪色时,才能停止滴定,否则提前结束滴定,影响滴定结果,故(11)错误;
(13)滴定管准确度为0.01mL,滴定管的两次读数得出NaOH溶液的体积应该为22.00mL,故(13)错误;
故答案为:(3)、(10)、(11)、(13).
点评 本题考查化学实验方案的评价,主要考查氧化还原滴定的操作、仪器、误差分析,难度不大,注意实验的基本操作方法及其规范性和注意事项,注意:滴定时眼睛注视锥形瓶内液体颜色变化而不是滴定管内液面变化,为易错点.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 是熵减反应 | B. | 是熵增效应大于能量效应 | ||
| C. | 是吸热反应 | D. | 是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
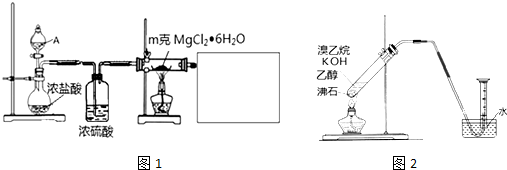
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强/MPa 体积分数/% 温度/℃ | 2.0 | 4.0 | 6.0 |
| 700 | 55.0 | a | b |
| 850 | c | 75.0 | d |
| 950 | e | f | 85.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
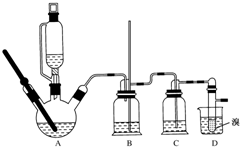 用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
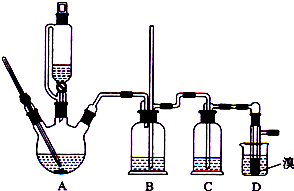
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
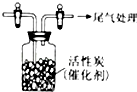 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③⑤ | C. | ①④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中每生成1 mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4转移4 mol电子 | |
| D. | Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com