
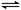 4NO(g)��6H2O(g)����H����905.9 kJ��mol��1��������������ȷ����
4NO(g)��6H2O(g)����H����905.9 kJ��mol��1��������������ȷ����| A���ﵽƽ��ʱ�ų�����Ϊ905.9 kJ������ʼʱͶ��4 mol NH3��5 mol O2 |
| B��ƽ��ʱ4v��(O2)��5v��(NO) |
| C��ƽ���ѹ���������ƽ��Ħ��������С |
| D��NH3��O2��ʼʱ���ʵ���֮�ȵ���4:5����ƽ��������ʵ�ת����һ����� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
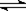 cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��D��Ũ��Ϊԭƽ���1.8��������������ȷ���� ( )
cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��D��Ũ��Ϊԭƽ���1.8��������������ȷ���� ( )| A��A��ת���ʱ�� | B��ƽ��������Ӧ�����ƶ� |
| C��D������������ | D��a �� c��d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��
�� ��������Ӧ
��������Ӧ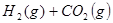
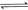
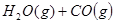 ������ʼŨ�����±���ʾ�����ƽ��ʱ����
������ʼŨ�����±���ʾ�����ƽ��ʱ����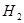 ��ת������60%�������ж���ȷ����
��ת������60%�������ж���ȷ����| ��ʼŨ�� | �� | �� | �� |
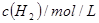 | 0.010 | 0.020 | 0.020 |
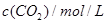 | 0.010 | 0.010 | 0.020 |
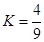
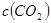 �Ǽ��е�2��
�Ǽ��е�2�� ��ת���ʾ���60%
��ת���ʾ���60%�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO��g����3H2��g������H����206 kJ/mol��һ�������������Ϊ1 L���ܱ������г���1 mol CH4��1 mol H2O�����CH4��g����CO��g����Ũ����ʱ��仯������ͼ��ʾ������˵����ȷ���� �� ��
CO��g����3H2��g������H����206 kJ/mol��һ�������������Ϊ1 L���ܱ������г���1 mol CH4��1 mol H2O�����CH4��g����CO��g����Ũ����ʱ��仯������ͼ��ʾ������˵����ȷ���� �� ��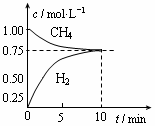
| A��10minʱ��CH4��ʾ�ķ�Ӧ����Ϊ0.075 mol?L��1?min��1 |
| B��ʹ�ø�Ч�����ܹ�����CO�IJ��� |
| C���������·�Ӧ��ƽ�ⳣ��Ϊ0.1875 |
D�������¶���ʹ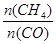 ���� ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 ��
�� �����������������������
�����������������������| A�������¶� | B�����뵪�� | C����ˮ��������ϵ�з��� | D���ø���Ч�Ĵ��� |
 2SO3(g) ��H=" ��196.6" kJ��mol�D1
2SO3(g) ��H=" ��196.6" kJ��mol�D1 2NO2(g) ��H= ��113.0 kJ��mol�D1
2NO2(g) ��H= ��113.0 kJ��mol�D1 SO3(g) + NO(g) �Ħ�H= ��
SO3(g) + NO(g) �Ħ�H= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3��״̬��ʱ��ƽ�⣬��O2��ת����Ϊ�� ��
2SO3��״̬��ʱ��ƽ�⣬��O2��ת����Ϊ�� ��
| A��40�� | B��60�� | C��80�� | D��90�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����

 2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���| �¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹǿ(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ�� (��10��3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
 NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3��5 min��ﵽƽ�⣬�úϳɷ�Ӧ5 min�ڵ�����v(NH3)=" 0.02" mol/��L��min��������ƽ��ʱ��������N2ת������ ��
2NH3��5 min��ﵽƽ�⣬�úϳɷ�Ӧ5 min�ڵ�����v(NH3)=" 0.02" mol/��L��min��������ƽ��ʱ��������N2ת������ ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com