
(1)①CaCO3(s) == CaO(s) + CO2(g);ΔH=177.7kJ/mol
②C(s) + H2O(g)== CO(g) + H2(g);ΔH= -131.3kJ/mol
③0.5H2SO4(l) + NaOH(l) == 0.5Na2SO4(l) + H2O(l);ΔH= -57.3kJ/mol
④C(s) + O2(g) == CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(g) == CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) == NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) == 2H2O(l);ΔH= -517.6kJ/mol
(a)上述热化学方程式中,不正确的有
(b)根据上述信息,写出C转化为CO的热化学方程式_ 。
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g) △H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则其逆反应的活化能为 
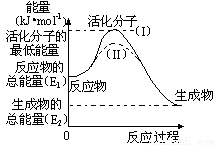
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为________(阿伏加德罗常数用NA表示),放出的热量为________kJ。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(1)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
[B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
(2)常温下,0.1 mol·L-1的氯化铵溶液pH=5.1.若常温下氨水的电离常数Kb=10-X,则x= 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期中测试化学试卷(解析版) 题型:填空题
如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:
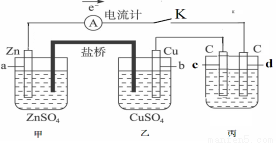
(1)若用此装置在铁制品上镀铜,在丙装置中,电极d应换成 。
(2)若丙池中的电解液为NaCl溶液,则电解时的离子方程式是 ;
(3)若丙池中的电解液为CuSO4溶液,则阳极的电极反应式为 ,电解时的化学反应方程式为 。
(4)若丙池中的电解液为500毫升1mol/L含CuSO4的NaCl溶液,当两极都生成11.2L(标况下)气体时,则丙池中CuSO4溶液的物质的量浓度是 。(忽略反应过程当中的体积变化)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高一上12月月考化学卷(解析版) 题型:选择题
取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积 之比是
A.1:1 B.1:2 C. 1:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上期中测试化学试卷(解析版) 题型:选择题
下列事实或现象与胶体性质无关的是
A.向三氯化铁溶液中加入NaOH溶液出现红褐色沉淀
B.煮沸的 FeCl3溶液冷却后,用一束光照射,有一条光亮的通路
C.胶态金属氧化物分散于玻璃中制成有色玻璃
D.明矾溶于水可以用来净水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是
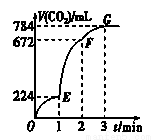
A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol/(L·min)
C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D.F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上11月月考化学试卷(解析版) 题型:选择题
下列物质中,不能发生消去反应的是
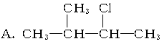 B.CH2 BrCH2Br
B.CH2 BrCH2Br
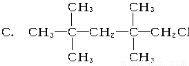 D.CH2ClCH2CH3
D.CH2ClCH2CH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光现代中学高二上12月月考化学卷(解析版) 题型:填空题
研究难溶电解质的沉淀溶解平衡及在生产生活中应用意义重大。
(1)FeS沉淀废水中的Hg2+的反应式为:_________________;
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2 (s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)•c2(OH-)=2×10-20mol2•L-2;
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)•c2(OH-)=2×10-20mol2•L-2;
①某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于_____;
②要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液中OH-浓度为__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第四次月考化学试卷(解析版) 题型:选择题
有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为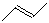 。有机物X的键线式为
。有机物X的键线式为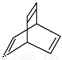 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.X的化学式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为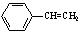
C.X能使高锰酸钾酸性溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com