
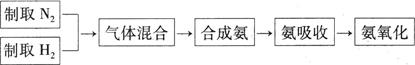

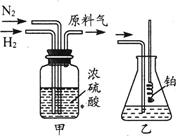
 4NO+6H2O
4NO+6H2O

科目:高中化学 来源:不详 题型:实验题
| 气体 | a | b | c | d |
| Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓H2SO4 |
| NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
| NO | 稀HNO3 | 铜屑 | H2O | P2O5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
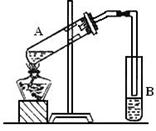
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.SO2、H2S、Cl2 | B.SO2、O2、NH3 |
| C.SO2、CO2、O2 | D.HCl、H2S、HI |
查看答案和解析>>
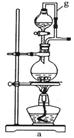
科目:高中化学 来源:不详 题型:实验题
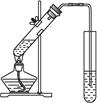
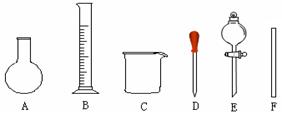
| A.用量筒准确量取所需的浓硫酸,沿玻璃棒倒入盛有适量水的烧杯中。并用玻璃棒不断搅拌至冷却 |
| B.将烧杯中的硫酸沿玻璃棒注入所选的容量瓶中① |
| C._______________________________________________________________________ |
| D.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm 处 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.浓硝酸和铜反应制备NO2 |
| B.浓氨水和生石灰反应制备氨气 |
| C.锌和盐酸反应制备氢气 |
| D.碳酸钙和盐酸反应制备二氧化碳 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
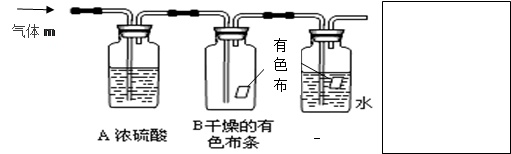
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
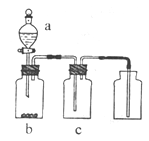
| | 气体 | a | b | C |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| C | CO2 | 稀硫酸 | Na2CO3固体 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com