
【题目】可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),反应过程中,当其他条件不变时,C的体积分数ψ(C)在不同温度和不同压强的条件下随时间的变化如图所示。
eC(g)+fD(g),反应过程中,当其他条件不变时,C的体积分数ψ(C)在不同温度和不同压强的条件下随时间的变化如图所示。
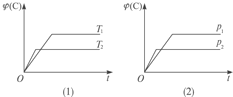
下列叙述正确的是()
A. 平衡后,若使用催化剂,C的体积分数增大
B. 平衡后,若温度升高,化学平衡向正反应方向移动
C. 化学方程式中,化学计量数的关系为n<e+f
D. 平衡后,增加A的质量,化学平衡向正反应方向移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表中如图所示的一些物质或概念间的从属关系,不正确的是
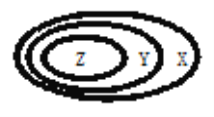
Z | Y | X | |
A | 氧化物 | 化合物 | 纯净物 |
B | 非电解质 | 电解质 | 化合物 |
C | 胶体 | 分散系 | 混合物 |
D | 碱性氧化物 | 金属氧化物 | 氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H(![]() ),是一种常见的抗结肠炎药物。如图是利用芳香烃A为原料设计制备H的路线。
),是一种常见的抗结肠炎药物。如图是利用芳香烃A为原料设计制备H的路线。

已知:①A蒸气的密度是相同条件下氢气密度的46倍;
②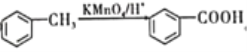 。
。
回答下列问题
(1)A的名称是_______,C中含有官能团的名称是____。
(2)写出C生成D的化学方程式:______,该反应的类型是______。
(3)G的结构简式是______。
(4)设计C→D和E→F两步反应的目的是______。
(5)化合物X是D的同分异构体,符合下列条件的X共______种。
①芳香族化合物,且苯环上有两个取代基②能发生水解反应
写出其中核磁共振氢谱显示有4种不同化学环境的氢原子,峰面积之比为3:3:2:2的所有X的结构简式:______。
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线(无机试剂任选)___________。
的合成路线(无机试剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下, pH值相同的盐酸和醋酸溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
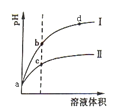
A.曲线Ⅰ为醋酸稀释时pH值变化曲线
B.b点溶液中水的电离程度比c点溶液中水的电离程度大
C.a点时,加入相同大小的锌粒,与盐酸反应的速率大
D.加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
![]()
(1)若升高温度,该反应的平衡常数变大,则ΔH_______0(填“大于”或“小于”)。该反应在_______________条件下能自发进行。
(2)维持体系总压强ρ恒定,在温度T时,物质的量为2mol、体积为1L的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为80%,则在该温度下反应的平衡常数K=_____。
(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓ +3H+
B.向氯化钙溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓ +2H+
C.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH--=CaCO3↓ +H2O
D.金属镁与稀盐酸反应:Mg+2H++2Cl-=MgCl2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯其反应式为C+K2Cr2O7+H2SO4=CO2+K2SO4+Cr2(SO4)3+H2O(未配平)
(1)配平上述方程式__C+__K2Cr2O7+__H2SO4=__CO2+ __K2SO4+__Cr2(SO4)3+__H2O
(2)上述反应中氧化剂是_______(填化学式),氧化产物是__________(填化学式)
(3)H2SO4在上述发应中表现出来的性质是_______(填序号)
a.氧化性 b.氧化性和酸性 c.酸性 d.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为__________ L
(5)要使10mL0.5mol/L的K2Cr2O7,溶液被还原,至少要加入 ________ mL2mol/L的H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分FeS2)是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如下图所示。

下列有关说法不正确的是
A. 经氧化后的黄铁矿可能呈现与铁锈类似的红褐色
B. a步反应中每生成1 mol FeSO4转移电子的物质的量为7 mol
C. 氧化过程会产生较多酸性废水破坏矿区生态环境
D. 标准状况下,0.1 mol FeS2完全被氧化时大约消耗空气40 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A. CH2=CHCOOH和油酸 B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇
(1)互为同位素的是________;
(2)互为同系物的是________;
(3)互为同素异形体的是________;
(4)互为同分异构体的是________;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com