
分析 (1)浸取时要将旧电池拆解、粉碎入水中搅拌浸取;
(2)滤液经操作蒸发、结晶得到固体物质;
(3)MnO(OH)中的锰元素是+3价变+2价得电子,所以过氧化氢失电子,生成氧气;
(4)n(Mn2+)+n(Zn2+)=0.8mol/L×1000L=800mol,已有铁元素0.1mol/L×1000L=100mol,由电荷守恒可知MnxZn(1-x)Fe2O4中Fe2O42-800mol,其中铁元素的物质的量为800mol×2=1600mol;
(5)从双氧水分解所常用的催化剂的角度分析另外一种可能;
(6)结晶时,处理不当易生成MnFe2O4和ZnFe2O4的原因是没有搅拌均匀;
(7)Fe是活性电极,活性电极作阳极,自身失去电子.
解答 解:(1)浸取时要将旧电池拆解、粉碎入水中搅拌浸取,所以浸取时的操作有拆解、粉碎和搅拌,并不需要改变温度、压强,
故选:AC;
(2)滤液经操作蒸发结晶得到KOH固体,所以滤液经蒸发至有大量晶体产生时停止加热,
故答案为:蒸发至有大量晶体产生时停止加热;
(3)MnO(OH)中的锰元素是+3价变+2价得电子,所以过氧化氢失电子,生成氧气,反应的化学方程式为:2MnO(OH)+H2O2+4H+═2Mn2++O2↑+4H2O,
故答案为:2MnO(OH)+H2O2+4H+═2Mn2++O2↑+4H2O;
(4)n(Mn2+)+n(Zn2+)=0.8mol/L×1000L=800mol,由电荷守恒可知MnxZn(1-x)Fe2O4中Fe2O42-800mol,其中铁元素的物质的量为800mol×2=1600mol,已有铁元素0.1mol/L×1000L=100mol,还需加入铁的物质的量为1600mol-100mol=1500mol,质量为1500mol×56g/mol=84000g=84kg,
故答案为:84;
(5)氧化时,因为分解所需双氧水的量比理论值大得多,除温度过高外,另一种可能就是双氧水在Fe3+起催化作用分解,
故答案为:生成Fe3+起催化作用促使双氧水分解;
(6)最后一步结晶时,要搅拌均匀,使MnxZn(1-x)Fe2O4均匀结晶,防止生成MnFe2O4和ZnFe2O4,
故答案为:均匀结晶(或搅拌均匀);
(7)Fe是活性电极,活性电极作阳极,自身失去电子,阳极电极反应式为Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+.
点评 本题考查无机化学工艺、物质的分离和提纯实验操作、电化学原理和计算,综合性较强,侧重于实验能力、计算能力、理论应用能力的考查,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
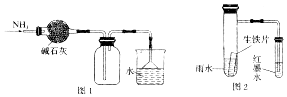
| A. | 图1所示的装置可用于干燥、收集并吸收多余的氨气 | |
| B. | 用广泛pH试纸测得0.1mol•L-1NaClO溶液的pH值约为12 | |
| C. | 用蒸发溶剂的方法将10%的Ca(HCO3)2溶液变为20%的Ca(HCO3)2溶液 | |
| D. | 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g质量分数为46%的乙醇水溶液中所含原子数目为0.6NA | |
| B. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| C. | 常温常压下.4.4gN2O与CO2的混合气体中含的原子数目为0.3NA | |
| D. | 常温下,1molC5H12中含有共价键数为16NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 乙酸溶于水可以电离,属于离子化合物 | |
| D. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| B. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| C. | W的气态氢化物比X的稳定 | |
| D. | WX2与ZY2中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
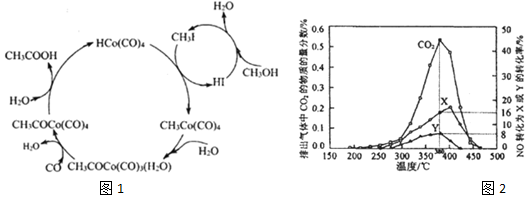
| 模拟尾气 | 气体 | 碳烟 | ||
| NO | O2 | He | ||
| 物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,Ksp(AgI)>Ksp(AgCl) | |
| B. | 由于AgCl与AgI的饱和水溶液几乎都不导电说明这两种物质均为非电解质 | |
| C. | 分别用等体积的蒸馏水和0.01 mol/L KI溶液洗涤AgI沉淀,用水洗涤沉淀损失量大 | |
| D. | 将AgCl与AgI的饱和溶液等体积混合后,再加入足量浓AgNO3溶液,只有AgI沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火山喷发 | |
| B. | 自然界中游离态硫缓慢氧化 | |
| C. | 煤、石油等含硫燃料的大量燃烧、硫矿石的冶炼及硫酸工业等产生的工业废气 | |
| D. | 汽车尾气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com