
【题目】设NA为阿伏加德罗常数的数值,下列有关说法正确的是
A.60克的乙酸和葡萄糖混合物充分燃烧消耗O2分子数为2NA
B.5.8g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.04NA
C.把4.6g乙醇完全氧化变成乙醛,转移电子数为0.1NA
D.实验室制取氧气方法有多种,制取1molO2转移电子数均是4NA
【答案】A
【解析】
A.乙酸与葡萄糖最简式都是CH2O,1个CH2O完全燃烧消耗1个氧气分子,60克的乙酸和葡萄糖混合物含有CH2O物质量为2mol,充分燃烧消耗2NA个O2,故A正确;
B.熟石膏(2CaSO4H2O)的物质的量n=![]() =0.02mol,由熟石膏(2CaSO4H2O)的化学式可知,1mol熟石膏(2CaSO4H2O)中含1mol水,故0.02mol水中含0.02mol水,即0.02NA个,故B错误;
=0.02mol,由熟石膏(2CaSO4H2O)的化学式可知,1mol熟石膏(2CaSO4H2O)中含1mol水,故0.02mol水中含0.02mol水,即0.02NA个,故B错误;
C.把4.6g乙醇物质的量为0.1mol,完全氧化变成乙醛,碳元素由乙醇中的-2价升高乙醛中的-1价,故转移电子数为0.2NA,故C错误;
D.实验室可以用双氧水、KClO3和KMnO4来制取氧气,当用KClO3和KMnO4来制取氧气时,氧元素由-2价变为0价,故制取1mol氧气转移4NA个电子,当用双氧水制取氧气时,氧元素由-1价变为0价,故制取1mol氧气时转移2NA个电子,故D 错误;
故答案为A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(中的ΔH表示生成1 mol 产物的数据)。
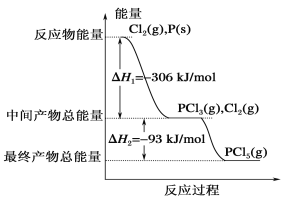
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_____。
(2)PCl5(g)=PCl3(g)+Cl2(g) ΔH2=_____
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__,P和Cl2一步反应生成1molPCl5的ΔH4____(填“大于”“小于”或“等于”)ΔH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰亚胺是综合性能最佳的有机高分子材料之一,已广泛应用在航空、航天、微电子等领域。某聚酰亚胺的合成路线如图(部分反应条件己略去):
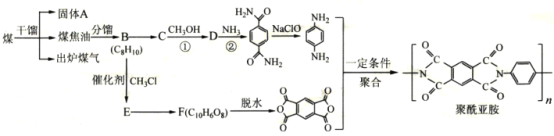
己知下列信息:
①芳香族化合物B的一氯代物有两种
②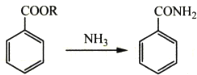
③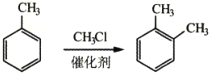
回答下列问题:
(1)固体A是___(写名称);B的化学名称是___。
(2)反应①的化学方程式为___。
(3)D中官能团的名称为___;反应②的反应类型是___。
(4)E的分子式为___;己知1mo1F与足量的NaHCO3反应生成4mo1CO2,则F的结构简式是___。
(5)X与C互为同分异构体,写出同时满足下列条件的X的结构简式___。
①核磁共振氢谱显示四种不同化学环境的氢,其峰面积之比为2:2:1:1
②能与NaOH溶液反应,1mo1X最多消耗4mo1NaOH
③能发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
(6)参照上述合成路线,以甲苯和甲醇为原料(无机试剂任选)设计合成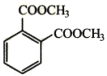 的路线___。
的路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:

请回答下列问题:
(1)A的化学名称为______;C中官能团的名称是_______。
(2)③的反应试剂和反应条件分别是_______,该反应类型是________。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是________
(4)反应④的化学方程式为__________
(5)G的相对分子质量为__________。
(6)![]() 是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
①![]() 直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
(7)参照上述合成路线,以CH3CH2COCl和![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]() 的路线为(其他无机试剂任选)_____。
的路线为(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(2)Z的单质与水反应的化学方程式是___;R与Q两元素最高价氧化物水化物反应的离子方程式___。
(3)Y与R相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式___。
(5)反应3X2(g)+P2(g)![]() 2PX3(g)过程中的能量变化如图所示回答下列问题:
2PX3(g)过程中的能量变化如图所示回答下列问题:
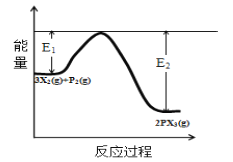
①该反应是___反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?___,原因是___(从能量说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________,烟花燃放过程中,钾元素中的电子跃迁的方式是___________,K、S、N、O四种元素第一电离能由大到小的顺序为___________。上述反应涉及的元素中电负性最大的是___________(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________,CO2分子的立体构型为___________。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________。
③CO分子中π键与σ键个数比为___________。
(3)超氧化钾的晶胞结构图如下:
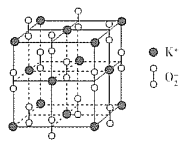
则与K+等距离且最近的K+个数为___________,若晶胞参数为dpm,则该超氧化物的密度为___________g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
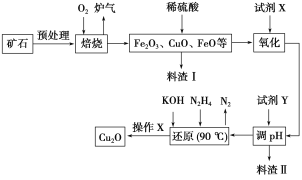
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及硅酸盐材料的说法正确的是![]()
A.SiO2既可以与NaOH溶液反应,也可以与氢氟酸反应,因此SiO2属于两性氧化物
B.高纯度的硅单质广泛用于制作光导纤维
C.普通玻璃、石英玻璃、水泥等均属于硅酸盐材料
D.长石的主要成分为KAlSi3O8,用氧化物形式表示为K2OAl2O36SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是无色、具有果香气味的液体。某同学采用12.0mL96%密度为1.05g/mL的乙酸、23mL95%密度为0.75g/mL的乙醇、12.0mL浓硫酸、饱和Na2CO3溶液制备乙酸乙酯,其实验装置如图所示(烧杯、部分夹持装置、温度计已略去)。
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.2 |
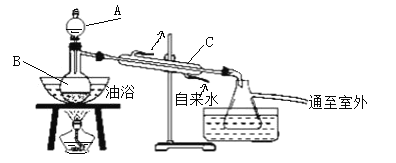
①先向蒸馏烧瓶B中加入试剂__,然后通过仪器A慢慢加入__;
②加热保持油浴温度为135~145℃,至不再有液体流出后,停止加热;
③取带有支管的锥形瓶,将一定量的饱和Na2CO3溶液分批、少量、多次地加入馏出液中,再将混合物分液,弃去水层,得到有机层。
试回答下列问题:
(1)①蒸馏烧瓶B加入试剂__,然后通过仪器A慢慢加入__。
(2)写出制备乙酸乙酯的化学方程式__。
(3)仪器A的名称是__;浓硫酸的作用是__;仪器C的作用是__。
(4)反应中所用的乙醇是过量的,其目的是__。
(5)③中加入饱和碳酸钠溶液的作用__,分批、少量、多次地加入饱和碳酸钠的原因是__。
(6)从③中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__,再加入无水硫酸钠,然后进行蒸馏,收集77.2℃的馏分,以得到纯净的乙酸乙酯9.2g,计算此实验中生成乙酸乙酯的产率为__(写出计算的表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com