
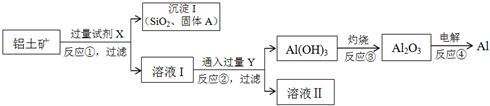
分析 由题给信息可知,铝土矿加入过量试剂X可将铝与其它杂质分离,结合“NaOH溶液与二氧化硅反应非常缓慢,在工业生产时不必考虑”可知试剂X应为NaOH溶液,所得固体A含有SiO2、Fe2O3、MgO、CuO,滤液Ⅰ含有NaAlO2,通入过量Y生成氢氧化铝沉淀,则Y为CO2,滤液Ⅱ为NaHCO3溶液,灼烧氢氧化铝生成氧化铝,电解熔融的氧化铝可生成Al,以此解答该题.
解答 解:由题给信息可知,铝土矿加入过量试剂X可将铝与其它杂质分离,结合“NaOH溶液与二氧化硅反应非常缓慢,在工业生产时不必考虑”可知试剂X应为NaOH溶液,所得固体A含有SiO2、Fe2O3、MgO、CuO,滤液Ⅰ含有NaAlO2,通入过量Y生成氢氧化铝沉淀,则Y为CO2,滤液Ⅱ为NaHCO3溶液,灼烧氢氧化铝生成氧化铝,电解熔融的氧化铝可生成Al,
(1)由以上分析可知固体A为Fe2O3、MgO、CuO;试剂X为NaOH,Y为CO2,故答案为:Fe2O3、MgO、CuO;NaOH;CO2;
(2)反应②为偏铝酸钠与过量二氧化碳的反应,生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)实验室里完成反应③应在坩埚中进行,灼烧氢氧化铝分解生成氧化铝,另外还需要酒精灯、三脚架、泥三角,故答案为:坩埚、酒精灯、三脚架、泥三角等;
(4)在电解池中阳极发生氧化反应,金属失去电子,电极反应式为Al-3e-═Al3+,电解精炼铝应以纯铝作阴极材料,故答案为:2Al-3e-═Al3+;D;
(5)铝土矿中Al2O3的含量为40.8%,1t铝土矿中的Al2O3的物质的量为$\frac{1×1{0}^{6}g×40.8%}{102g/mol}$=4000mol,与氢氧化钠溶液发生Al2O3+2NaOH=2NaAlO2+H2O,由方程式可知需要8000molNaOH,质量为$\frac{8000mol×40g/mol}{1×1{0}^{6}g/t}$=0.32t,
故答案为:0.32 t.
点评 本题考查混合物分离提纯方法的选择和应用,为高频考点,把握混合物分离流程及发生的反应为解答的关键,侧重物质性质及分离方法的考查,明确物质性质差异性即可提纯分离物质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 四种元素中离子半径最大的为M | |
| B. | Y、Z、M的氢化物中,M的氢化物沸点最高 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物,不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠可用于制备木材防火剂 | B. | 硅单质广泛用于光纤通讯 | ||
| C. | 硅酸可由二氧化硅与水反应制得 | D. | 水晶项链是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
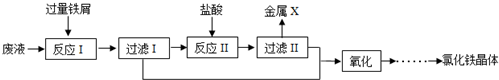
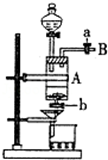 三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
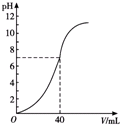 用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )| A. | 0.5 mol•L-1 100 mL | B. | 0.5 mol•L-180 mL | ||
| C. | 1 mol•L-160 mL | D. | 1 mol•L-180 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com