
����Ŀ��������һ�������Դ������ʹ�����Ϊ�������õĹؼ��������ǵ�ǰ��ѧ����Ҫ��ע���ȵ����⣮
��1���ü�����ȡ������������Ӧ�������仯��ͼ��ʾ�� 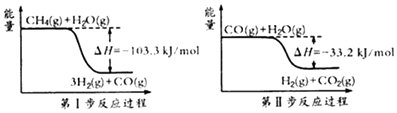
�ټ����ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
�ڵڢ�ӦΪ���淴Ӧ��800��ʱ����CO����ʼŨ��Ϊ2.0molL��1 �� ˮ��������ʼŨ��Ϊ3.0molL��1 �� �ﵽ��ѧƽ��״̬���CO2��Ũ��Ϊ1.2molL��1 �� ��CO��ƽ��ת����Ϊ ��
��2��NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ����NaBO2 �� �ҷ�Ӧǰ��BԪ�صĻ��ϼ۲��䣬�÷�Ӧ�Ļ�ѧ����ʽΪ �� ��Ӧ����1mol NaBH4ʱת�Ƶĵ�����ĿΪ ��
��3������ɽ����л�������û�����ͱ�֮��Ŀ��淴Ӧ��ʵ������ͼ��⣮ 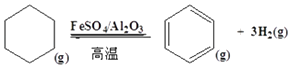
��ij�¶��£�����������м��뻷���飬����ʼŨ��Ϊa molL��1 �� ƽ��ʱ����Ũ��Ϊb molL��1 �� �÷�Ӧ��ƽ�ⳣ��K=���ú�a��b�Ĺ�ϵʽ�����
���𰸡�
��1��CH4��g��+2H2O��g��=4H2��g��+CO2��g����H=��136.5kJ/mol��60%
��2��NaBH4+2H2O=NaBO2+4H2����4NA��2.408��1024
��3��![]() mol3?L��3
mol3?L��3
���������⣺��1���ٸ��ݵ�һ����Ӧ���̿��Եó���CH4��g��+H2O��g��=3H2��g��+CO��g������H=��103.3KJ/mol��
���ݵڶ�����Ӧ���̿��Եó���CO��g��+H2O��g��=H2��g��+CO2��g������H=��33.2KJ/mol��
���ݸ�˹���ɣ�������ʽ��ӿɵã�CH4��g��+2H2O��g��=4H2��g��+CO2��g����H=��136.5 kJ/mol��
���Դ��ǣ�CH4��g��+2H2O��g��=4H2��g��+CO2��g����H=��136.5 kJ/mol��
����CO��ƽ��ת����Ϊx��
CO��g��+ | H2O��g��= | H2��g��+ | CO2��g�� | |
��ʼŨ�ȣ� | 2.0 | 3.0 | 0 | 0 |
�仯Ũ�ȣ� | 1.2 | 1.2 | 1.2 | 1.2 |
ƽ��Ũ�ȣ� | 0.8 | 0.8 | 1.2 | 1.2 |
��CO��ƽ��ת����Ϊ ![]() ��100%=60%��
��100%=60%��
���Դ��ǣ�60%����2��NaBH4��ˮ��Ӧ����NaBO2 �� �ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬NaBO2��BԪ�ػ��ϼ�Ϊ+3�ۣ�����NaBH4��HԪ�صĻ��ϼ�Ϊ��1�ۣ�����HԪ�ػ��ϼ��ɩ�1�ۡ�+1�۱�Ϊ0�ۣ��ٽ��ת�Ƶ����غ���ƽ����ʽΪNaBH4+2H2O=NaBO2+4H2������Ӧ����1mol NaBH4ʱת�Ƶ����ʵ���=1mol��4����1��0��=4mol������ת�Ƶ�����Ϊ4NA��2.408��1024 �� ���Դ��ǣ�NaBH4+2H2O=NaBO2+4H2����4NA��2.408��1024����3�����������ʼŨ��ΪamolL��1 �� ƽ��ʱ����Ũ��ΪbmolL��1 �� ͬһ�����и����ʷ�Ӧ�����ʵ���Ũ��֮�ȵ����������֮�ȣ����Ը��ݷ���ʽ֪���������ƽ��Ũ��Ϊ��a��b��mol/L��������Ũ��Ϊ3bmol/L����ƽ�ⳣ��K= ![]() mol3L��3=
mol3L��3= ![]() =
= ![]() mol3L��3 ��
mol3L��3 ��
���Դ��ǣ� ![]() mol3L��3 ��
mol3L��3 ��
�����㾫�������û�ѧƽ��ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����0.1000mol/L������ζ�ijδ֪Ũ�ȵ�NaOH��Һ��ʾ��ͼ��ij�εζ�ǰ�����ʢ������ζ�����Һ���λ�ã���ش�
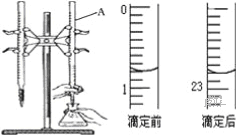
��1������A��������__________________��
��2�����������������ζ�ǰ����Ϊ_____mL���ζ������Ϊ______mL��
��3��ijʵ��С��ͬѧ������ʵ���ʵ���������±���ʾ�����ݱ������ݼ�����Ĵ���NaOH��Һ��Ũ����________________����������λ��Ч���֣�
ʵ�� ��� | ����NaOH��Һ�������mL�� | �ζ�ǰ����� �������mL�� | �ζ�������� ���������mL�� |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
��4���ζ������ɷֽ�Ϊ���¼��������õ�������������ˮϴ������
A���ü�ʽ�ζ�������ƿ��ע��20.00mL����NaOH��Һ��������2��3�η�̪��
B���ñ���Һ��ϴ��ʽ�ζ���2��3�Σ�
C����ʢ�б���Һ����ʽ�ζ��̶ܹ��ã����ڵζ��ܼ���ʹ֮������Һ��ʹ���������ݣ�
D��ȡ������ע����ʽ�ζ������̶�0����2��3cm��
E������Һ����0��0���¿̶ȣ����¶�����
F������ƿ���ڵζ��ܵ����棬�ñ�����ζ����յ㲢���µζ���Һ��Ŀ̶���
��ȷ���������˳���ǣ��������ĸ��д��_____________��
��5���жϵ���ζ��յ��ʵ��������________________________________��
��6�������м��ּٶ�����������ۣ���������Ӱ��������ƫ��������ƫ������
���������B����ʡ�ԣ��Բⶨ�����Ӱ����_________��
��ȡ����Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ��_________��
�����ζ�ǰ��ƿδ�ô���Һ��ϴ���Բⶨ�����Ӱ����___________��
�ܱ�Һ����ʱ�����ζ�ǰ���ӣ��ζ����ӣ��Բⶨ�����Ӱ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һƿ�Ҷ����ͱ������Ļ�����֪���ǵ��������±����ݴˣ����Ҷ����ͱ���������������ѷ�����( )
���� | ����ʽ | �۵�� | �е�� | �ܶ�(g/cm3) | �ܽ��� |
�Ҷ��� | C2H6O2 | -11.5 | 198 | 1.11 | ������ˮ���Ҵ� |
������ | C3H8O3 | 17.9 | 290 | 1.26 | �ܸ�ˮ���ƾ�������Ȼ��� |
A.�ᾧ��B.��ȡ��C.��Һ��D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮƿ��ʱ�ݳ��������ݣ����ݵ���Ҫ�ɷ�Ϊ
A��N2 B��CO2 C��O2 D��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ���ͬ���ʵ���Ũ�ȵ�AgNO3��Һ�зֱ����ͬ�����NaCl��MgCl2��AlCl3��Һ��ǡ��ʹCl-��ȫת��Ϊ��������������Һ�����ʵ���Ũ��֮��Ϊ
A. 1:1:1 B. 1:2:3 C. 1:4:9 D. 6:3:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӷ�Ӧ�����ֽⷴӦ���û���Ӧ��������ԭ��Ӧ֮����ü��Ϲ�ϵ��ʾ������ȷ���ǣ� ��
A.
B.
C.
D.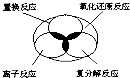
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������н��з�Ӧ��mX(g)��nY(g)![]() pZ(g)��qQ(g)��ʽ��m��n��p��qΪ��ѧ����������0��3min�ڣ����������ʵ����ı仯���±���ʾ��
pZ(g)��qQ(g)��ʽ��m��n��p��qΪ��ѧ����������0��3min�ڣ����������ʵ����ı仯���±���ʾ��
���� | X | Y | Z | Q |
��ʼ/mol | 0.7 | 1 | ||
2minĩ/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3minĩ/mol | 0.8 |
��֪��2min�ڣ���(Q)��0.075mol��L��1��min��1����(Z)�æ�(Y)��1��2��
��1������ʽ��m��______��n��______��p��______��q��______��
��2��2.5min�ڣ�Q��ת����Ϊ______________��
��3�����ڸ÷�Ӧ������������Ӧ���ʵĴ�ʩ��___________
A������������� B�����߲���Q C��ͨ�����X D�������¶�
��4���÷�Ӧ�ﵽ��ѧƽ��״̬ʱ___________
A������������ѹǿ���ֲ��� B�������������ܶȱ��ֲ���
C������������ƽ��Ħ���������ֲ��� D������Ӧ�������淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�鰴����ʵ������̽�������е����ȡ��
���裨һ��
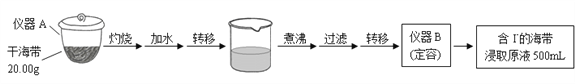
���裨����
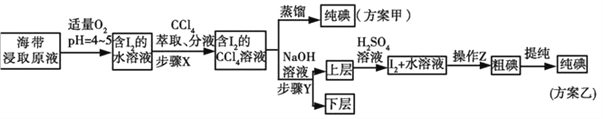
��֪����3I2��6NaOH��5NaI��NaIO3��3H2O���ڳ����£��ⵥ������ˮ��������CCl4��
��ش�
��1�����裨һ���е��������ƣ�����A______________�� ���� B_______________��
��2���ٷ�Һ©��ʹ��ǰ���©����©����Ϊ__________________________��
�ڲ���X�У���ȡ���Һ©���ڹ۲쵽��������_______________________��
�������йز���Y��˵������ȷ����_______________��
A.Ӧ����NaOH��Һ��Ũ�Ⱥ���� B������ת�������ӽ���ˮ��
C����Ҫ�dz�ȥ������ȡԭҺ�е��л����� D��NaOH��Һ�������Ҵ�����
�ܲ��裨�����в���Z��������_____________��
��3�������������������������_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼά����P(�ṹ��ͼ��ͼ��RΪ���)�����ڻ��������У�����һ��Ӫ��������������ά����P�������������
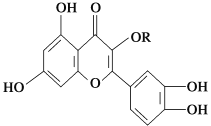
A. ������ˮ��Ӧ����1 mol��������������ˮ��Ӧ����6 mol Br2
B. ����NaOH��Һ��Ӧ��������NaHCO3��Һ��Ӧ
C. һ��������1 mol��������H2�ӳ�����H2�����Ϊ7 mol
D. ά����P��FeCl3��Һ������ɫ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com