
分析 (1)根据高锰酸钾在不同的条件下发生的反应的现象分析,不同环境中反应后的离子颜色不同,结合溶液酸碱性判断;
(2)得电子化合价降低的微粒发生还原反应,标注元素化合价的升高降低来判断;
(3)同一氧化还原反应中氧化剂的氧化性大于还原产物的氧化性;
(4)根据氧化还原反应中得失电子数相等配平方程式,并注意也要遵循原子守恒,该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得1个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是28,所以高锰酸钾的计量数是28,硫化钾的计量数是5;根据硫单质和转移电子之间的关系式计算转移电子数;
(5)等物质的量的氧化剂得到电子越多,生成碘越大,且IO3-的还原产物也为碘,以此来解答.
解答 解:(1)根据反应式知,不同环境中反应后的离子颜色不同,溶液的酸碱性不同溶液的颜色不同,所以溶液的颜色受溶液酸碱性的影响,故答案为:酸碱性;
(2)二氧化硫含有还原性,酸性条件下,高锰酸根离子得电子生成二价锰离子,所以高锰酸根离子有强氧化性,所以还原反应的过程为MnO4-→Mn2+,
故答案为:MnO4-;Mn2+;
(3)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色,说明PbO2氧化二价锰离子生成高锰酸根离子,所以PbO2作氧化剂,高锰酸根离子是氧化产物,所以PbO2的氧化性大于高锰酸根离子,故选a;
(4)该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得1个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是28,所以高锰酸钾的计量数是28,硫化钾的计量数是5,其它元素根据原子个数相等配平,所以方程式为:28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O,用单线桥法表示电子的转移为: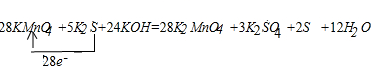
若生成6.4 g单质硫,设转移电子数是x,依据化学方程式定量关系计算
28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O 转移电子
2mol 28mol
$\frac{6.4g}{32g/mol}$ 2.8mol
故答案为:①28、5、24KOH、28、3、2、12H2O;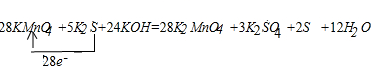 ②2.8mol;
②2.8mol;
(5)由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
a、1molMnO4-→Mn2+得5mole-,
b、1molFe3+→Fe2+得1mole-,
c、1molIO3-→I2得5mole-,
d、1molHNO3→NO得1mole-;
且IO3-的还原产物也为碘,则c中生成的I2就最多,
故选c.
点评 本题考查了有关物质的量的计算、氧化性和还原性的判断等知识点,难度中等,明确氧化性和还原性强弱的判断方法.


科目:高中化学 来源: 题型:选择题
| A. | 向氯水中加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,体积缩小,压强增大可使颜色变深 | |
| C. | 合成氨反应中用过量氮气与氢气反应可以提高氢气的转化率 | |
| D. | 将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与溴化钾溶液反应:Cl2+2Br-=2Cl-+Br2 | |
| B. | 铜片插人硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| C. | 单质铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 碳酸钠溶液与醋酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡正向移动 | |
| B. | 再达平衡时,n(A):n(B):n(C)仍为2:2:1 | |
| C. | 再达平衡时,C的体积分数减小 | |
| D. | 再达平衡时,正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于漂白纸浆 | |
| B. | 热的纯碱溶液可以去除物品表面的油污 | |
| C. | 钠钾合金常温下是液体,可用于快中子反应堆的热交换剂 | |
| D. | 浓硫酸的吸水性,可使蔗糖炭化,实验室常用作干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com