
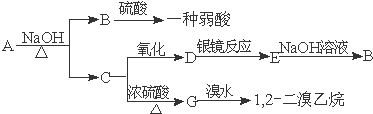
分析 具有水果香味的中性物质A能发生水解反应生成B、C,B和硫酸反应生成一种弱酸,则B是羧酸钠,C是醇,C被氧化生成D,D能发生银镜反应,则D为醛,D被氧化生成羧酸E,E和氢氧化钠反应生成羧酸钠B,则羧酸和醇分子中C原子相等,C发生消去反应生成G,G和溴发生加成反应生成1,2-二溴乙烷,则G结构简式为CH2=CH2、C结构简式为CH3CH2OH、D为CH3CHO、E为CH3COOH、B为CH3COONa、A为CH3COOCH2CH3,据此分析解答.
解答 解:具有水果香味的中性物质A能发生水解反应生成B、C,B和硫酸反应生成一种弱酸,则B是羧酸钠,C是醇,C被氧化生成D,D能发生银镜反应,则D为醛,D被氧化生成羧酸E,E和氢氧化钠反应生成羧酸钠B,则羧酸和醇分子中C原子相等,C发生消去反应生成G,G和溴发生加成反应生成1,2-二溴乙烷,则G结构简式为CH2=CH2、C结构简式为CH3CH2OH、D为CH3CHO、E为CH3COOH、B为CH3COONa、A为CH3COOCH2CH3,
(1)通过以上分析知,A、B、C、D结构简式分别为CH3COOCH2CH3、CH3COONa、CH3CH2OH、CH3CHO,
故答案为:CH3COOCH2CH3;CH3COONa;CH3CH2OH;CH3CHO;
(2)A是乙酸乙酯,A和氢氧化钠的反应方程式为:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH,D的银镜反应为CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+3NH3+2Ag↓+H2O,
故答案为:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH;CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+3NH3+2Ag↓+H2O.
点评 本题考查有机物推断,侧重考查分析推断能力,涉及醇、醛、羧酸、酯之间的转化,根据反应条件确定物质具有的官能团及其结构,熟练掌握常见有机反应类型,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 moL•L-1 | B. | 1.0 moL•L-1 | C. | 1.2 moL•L-1 | D. | 1.5 moL•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
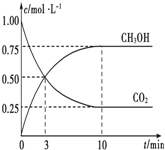 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A. | 欲增大平衡状态时$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$的比值,可采用升高温度的方法 | |
| B. | 达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 欲提高H2的平衡转化率只能加压减小反应容器的体积 | |
| D. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溶解后过滤的方法除去CaCl2中的少量的ZnSO4 | |
| B. | 用萃取的方法分离NaCl溶液和汽油 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用蒸馏的方法除去水中的不挥发的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com