
| A. | Mg2+、Zn2+、Cr3+、Fe3+ | B. | Cr3+、Fe3+、Zn2+、Mg2+ | ||
| C. | Fe3+、Cr3+、Zn2+、Mg2+ | D. | Zn2+、Mg2+、Cr3+、Fe3+ |
分析 溶液的pH控制在9附近,则c(OH-)=1.0×10-5mol/L,结合Ksp可计算各金属离子的浓度,进而比较浓度大小,以此解答该题.
解答 解:溶液的pH控制在9附近,则c(OH-)=1.0×10-5mol/L,则c(Mg2+)=$\frac{1.8×1{0}^{-11}}{(1{0}^{-5})^{2}}$mol/L=0.18mol/L;
c(Zn2+)=$\frac{1.0×1{0}^{-17}}{(1{0}^{-5})^{2}}$mol/L=1.0×10-7mol/L;
c(Cr3+)=$\frac{7.0×1{0}^{-31}}{(1{0}^{-5})^{3}}$mol/L=7.0×10-16mol/L;
c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-5})^{3}}$mol/L=4.0×10-23mol/L.
则离子浓度由大到小的顺序为Mg2+、Zn2+、Cr3+、Fe3+,
故选A.
点评 本题考查难溶电解质的计算,为高频考点,把握Ksp与离子浓度的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨稳定 | |
| B. | 1mol石墨比1mol金刚石的总能量高 | |
| C. | 若在等量氧气中充分燃烧,1mol金刚石比1mol石墨的释放的能量高 | |
| D. | 仅提供1.895 kJ的热能,工业上就能将1mol石墨转化为金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | At位于第七周期第ⅦA族,其气态氢化物的稳定性比HCl的强 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸:粘合剂、耐火材料 | B. | 硅胶:干燥剂、吸附剂、催化剂载体 | ||
| C. | 碳化硅:砂纸、砂轮 | D. | 分子筛:吸附剂、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
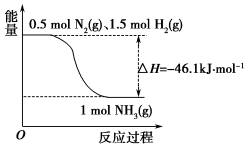 氨在工农业生产中应用广泛.
氨在工农业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(min) | 0 | t1 | t2 | t3 |
| NH3的物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
| A. | 0~t1min内,v(NH3)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移 | |
| C. | N2(g)+3H2(g)?2NH3(g)的活化能小于2NH3(g)?N2(g)+3H2(g)的活化能 | |
| D. | t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | 在①、②中分别加入氯化铵晶体,两溶液的pH值均增大 | |
| B. | 分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>② | |
| C. | 把①、④两溶液等体积混合后所得溶液显酸性 | |
| D. | 将溶液②和溶液③等体积混合,混合后所得溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )
如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )| A. | x可能表示该反应的平衡常数 | |
| B. | x可能表示平衡混合物的密度 | |
| C. | 当x表示Q的体积分数时,T2<T1 | |
| D. | 当x表示平衡混合物的物质的量时,T2<T1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com