
分析 (1)根据构造原理排布;
(2)相同类型的离子晶体中,晶体的熔点与晶格能成正比,晶格能与离子半径成反比;
(3)Al3+可以形成sp3型杂化轨道,[Al(OH)4]-中的配位数是4,据此判断其空间结构;
(4)同种元素的物质间元素的化合价越高,对应的含氧酸的酸性越强;
(5)[SiO4]四面体,Si的电子对数为4,杂化类型为sp3,两个结构单元通过共用的原子为O原子;
(6)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;根据密度$ρ=\frac{m}{V}$计算.
解答 解:(1)Ca属于20号元素,3d轨道能量大于4s轨道,所以Ca的电子排布式应是1s22s22p63s23p64s2,故答案为:1s22s22p63s23p64s2;
(2)MgO晶体的熔点比CaO高都属于离子晶体,Mg2+半径比Ca2+小,键能较大,所以氧化镁晶体的晶格能大于氧化钙,导致氧化镁晶体的熔点大于氧化钙,
故答案为:高;Mg2+半径比Ca2+小,MgO的晶格能较大;
(3)[Al(OH)4]-配离子的中心原子采取sp3杂化,配位数为4,故空间构型为正四面体型,故答案为:正四面体;
(4)同种元素的物质间元素的化合价越高,对应的含氧酸的酸性越强,H2SO4中S的正电荷高于H2SO3的正电荷,导致H2SO4的S-O-H中O的电子向S偏移的程度更大,更容易电离出H+,所以H2SO4的酸性强,
故答案为:H2SO4;H2SO4中S的正电荷高于H2SO3的正电荷,导致H2SO4的S-O-H中O的电子向S偏移的程度更大,更容易电离出H+,所以H2SO4的酸性强;
(5)[SiO4]四面体,Si的电子对数为4,杂化类型为sp3,由两个结构单元通过共用一个O原子形成的硅酸盐阴离子比[SiO4]四面体少一个O原子,阴离子的化学式为[Si2O7]6-,故答案为:sp3;[Si2O7]6-;
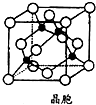
(6)以钙离子为中心,沿X、Y、Z三轴进行切割,上下左右前后,结合图片知,钙离子的配位数是6,若该晶胞的边长为anm,晶胞体积为(a×10-7cm)3,晶胞中有4个Ca原子、4个O原子,故晶胞质量为$\frac{4×40+4×16}{{N}_{A}}$g,故该氧化物的密度为$\frac{4×40+4×16}{{N}_{A}}$g÷(a×10-7cm)3=$\frac{2.24×1{0}^{23}}{{a}^{3}{N}_{A}}$g•cm-3,故答案为:6;$\frac{2.24×1{0}^{23}}{{a}^{3}{N}_{A}}$.
点评 本题考查了原子核外电子排布式、杂化类型、配合物、分子空间构型以及晶胞计算等知识点,注意硅酸盐中Si的价态为+4价,形成4个共价键可以帮助解答第(5)小题.


科目:高中化学 来源: 题型:解答题
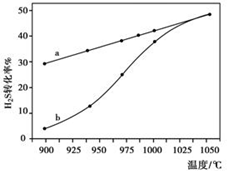 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的比例模型: | |
| B. | 氢氧根离子的电子式: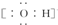 | |
| C. | 氯原子的结构示意图: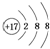 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 在 CuSO4溶液中加入一小块Na | Na溶解,生成沉淀 | 有Cu产生 |
| B | 将浓氨水滴加至烧瓶中的CaO上 | 产生的气体可使湿润的红色石蕊试纸变蓝 | 有氨气生成 |
| C | 在Fe(NO3)2溶液中加入稀H2SO4 | 溶液变为黄色 | 稀H2SO4具有氧化性 |
| D | 将氨气通入I2-淀粉溶液中 | 溶液蓝色褪去 | 氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64g Cu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA | |
| B. | 足量的CO2与39gNa2O2发生反应转移的电子数为NA | |
| C. | 18g的D2O与NA个-CH3具有相同的电子数 | |
| D. | 6.0g醋酸晶体中含有H+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
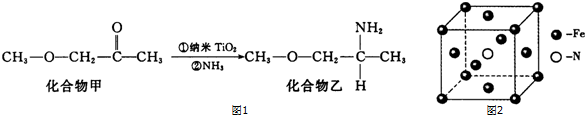
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小为W>X>Z>Y | |
| B. | X、Y、Z的氢化物的水溶液均呈酸性 | |
| C. | W与Y形成的三原子化合物既含极性共价键又含非极性共价键 | |
| D. | Z元素的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
.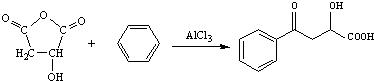 .
.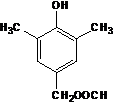 或
或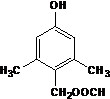 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com