
【题目】为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
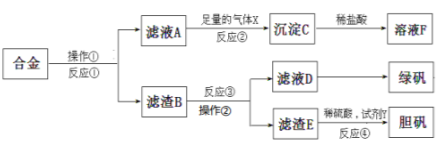
请回答:
(1)反应①、反应③所加试剂分别是___________、____________。从滤液D中得到绿矾晶体的实验操作是________________。
(2)写出反应①的化学方程式____________,反应②生成沉淀的离子反应方程式__________________。
(3)用NaOH检测滤液D中含有的金属离子,实验现象是:____________,其中涉及的氧化还原反应方程式为:____。
(4)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为H2O2,则反应④的总化学方程式为____________________。
【答案】
(1)NaOH 稀H2SO4;在隔绝空气的条件下,蒸发浓缩、冷却结晶
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑;AlO2- +CO2+2H2O=Al(OH)3↓+HCO3-
(3)先产生白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O==4Fe(OH)3
(4)3H2O+Cu+H2O2+H2SO4=CuSO4·5H2O;
【解析】
试题分析:合金加入足量的烧碱溶液后,金属铝溶解,滤渣为铁、铜;滤液A中通入二氧化碳气体,得到氢氧化铝沉淀;滤渣B加入稀硫酸,铁与稀硫酸反应,且会形成铁铜原电池,滤渣E溶解于稀硝酸,蒸发结晶得到绿矾。
(1)反应①、反应③所加试剂分别是氢氧化钠和稀硫酸。硫酸亚铁溶液被空气中氧气氧化,从滤液D中得到绿矾晶体需要在隔绝空气的条件下,蒸发浓缩、冷却结晶,故答案为:NaOH 稀H2SO4;在隔绝空气的条件下,蒸发浓缩、冷却结晶;
(2)金属铝可以和强碱氢氧化钠发生反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,偏铝酸钠溶液中通入过量二氧化碳,生成氢氧化铝沉淀,即AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)滤液D中含有亚铁离子,加入NaOH,实验现象为先产生白色絮状沉淀,迅速变为灰绿色,最后变为红褐色,涉及的氧化还原反应方程式为4Fe(OH)2+O2+2H2O==4Fe(OH)3,故答案为:先产生白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O==4Fe(OH)3;
(4)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:3H2O+Cu+H2O2+H2SO4=CuSO4·5H2O,故答案为:3H2O+Cu+H2O2+H2SO4=CuSO4·5H2O。


科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度为
A.(b-a)/V mol·L-1 B.2(2b-a)/V mol·L-1
C.2(b-a)/V mol·L-1 D.(2b-a)/V mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个恒容休积均为2.0L的容器中发生反应:PCl5(g) ![]() PCl3(g)+Cl2(g),下列说法正确的是
PCl3(g)+Cl2(g),下列说法正确的是
编号 | 温度(℃) | 起始/(mol) | 平衡/(mol) | 达到平衡所需时间(s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A. 平衡常数K:容器Ⅱ>容器Ⅲ
B. 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C. 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1mol/(Ls)
D. 起始时向容器Ⅲ中充入PCl50.30mol、PCl30.45mol和Cl20.10mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取mg镁铝合金在一定浓度的稀硫酸中恰好完全溶解,向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的SO42-的物质的量为![]()
③反应过程中转移的电子为![]() mol
mol
④标准状况下生成H2的体积为![]()
A. ①②③④ B.①②③ C.①②④ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 活性炭具有还原性,可用作冰箱除味剂
B. 二氧化硫具有氧化性,可用作造纸漂白剂
C. Al2O3具有很髙的熔点,可用于制造熔融烧碱的坩埚
D. FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的叙述,正确的是( )
A.离子化合物中一定只含有离子键
B.单质分子中均存在化学键
C.仅含有共价键的化合物一定是共价化合物
D.由不同种非金属元素的原子形成的共价化合物一定只含极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3g Na在干燥的空气中长时间放置,得到Na的氧化物3.5g试确定该氧化物的组成为_____________,它们的质量分别为_____________若将此氧化物投入足量水中,可得O2__________g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com