


科目:高中化学 来源: 题型:
| A、加热时有无气体放出 |
| B、滴加盐酸时放出气泡的剧烈程度 |
| C、溶于水后滴加CaCl2稀溶液有无白色沉淀生成 |
| D、溶于水后滴加澄清石灰水有无白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验现象 | 原因分析 |
| A | 浓的硫化钠溶液有臭味 | 硫离子多步水解生成硫化氢,硫化氢有臭味 |
| B | 新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
| C | SO2通入溴水中,溴水褪色 | SO2具有漂白性,使其褪色 |
| D | 向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 | 在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成了CO2、SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
| B、在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO32- |
| C、在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2可以看成:KOH、Ba(OH)2、BaCO3、K2CO3 |
| D、在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、H+、SO42-、Cl- |
| B、Ca2+、H+、NO3-、CO32- |
| C、Fe3+、Na+、SCN-、OH- |
| D、Cu2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释后,溶液中各离子浓度均变小 | ||||
| B、原溶液中,C(Na+)=C(HCO3-)+C(H2CO3)=0.1mol/L | ||||
C、稀释后,溶液中
| ||||
| D、原溶液加入少量NaOH溶液后,其碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甲烷的电子式: |
B、氮原子的L层电子轨道表示式: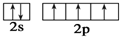 |
| C、硫离子的核外电子排布式:1s22s22p63s23p4 |
| D、碳原子最外层电子排布:2s22p2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com