
分析 (1)①不溶性杂质与溶液分离,利用过滤;
②滴加H2O2能将亚铁离子氧化;Cu2(OH)2CO3粉末使铁离子水解平衡正向移动;
③由溶液得到晶体,可进行溶解,然后蒸发,冷却结晶能析出晶体,水浴加热能保持温度恒定,防止晶体分解;
(2)①A中加入适量CuO粉末,观察到有气体生成,则CuO起催化剂的作用;
②测定反应速率,需要知道一定时间内气体的体积变化,以此选择仪器.
解答 解:(1)①不溶性杂质与溶液分离,利用过滤,则操作步骤为加适量水溶解,搅拌,过滤,
故答案为:加适量水溶解,搅拌,过滤;
②Cu2(OH)2CO3粉末使铁离子水解平衡正向移动,目的是调节溶液的酸性,使Fe3+水解全部转化为Fe(OH)3沉淀,
故答案为:使Fe3+可全部转化为Fe(OH)3沉淀,而Cu2+不会转化为Cu (OH)2沉淀;
③由溶液得到晶体,可进行溶解,然后蒸发,为饱和溶液,冷却结晶能析出晶体,水浴加热能保持温度恒定,防止CuSO4•5H2O晶体分解,
故答案为:将CuSO4•5H2O溶液加热蒸发至有晶体出现时,停止加热;受热均匀,温度易于控制在1000C以下;
(2)①A中加入适量CuO粉末,观察到有气体生成,而B中没有气体生成,则说明CuO起催化剂的作用,
故答案为:CuO可加快H2O2分解的反应速率,是H2O2分解反应的催化剂;
②测定反应速率,需要知道一定时间内气体的体积变化,除导管、橡皮塞、水槽、集气瓶外还必须有量筒、秒表(或计时器、手表),
故答案为:秒表、橡皮塞、导管、集气瓶、量筒.
点评 本题考查制备实验方案的设计及物质的分离、提纯,明确流程中的各步操作的目的是解答的关键,结合物质的性质及反应原理即可解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2OH | B. | HOCH2CH(OH)CH3 | C. | HOCH2CH2CH2OH | D. | CH3CH(OH)CH(OH)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱溶液可洗涤餐具上的油污 | |
| B. | 新型氢动力汽车的使用可减少雾霾的产生 | |
| C. | 钢铁厂用热还原法冶炼铁 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅用溴水一种试剂可将苯、己烯、乙醇、四氯化碳、亚硫酸钠溶液五种物质鉴别开来 | |
| B. | Na2O2中既含离子键又含共价键,其所含的阳离子对阴离子的个数比为2:1 | |
| C. | 甲烷、新戊烷与2,2,3,3-四甲基丁烷的一氯代物均只有一种 | |
| D. | 硬脂酸(C17H35COOH)与乙酸、甲醇与乙二醇(HOCH2CH2OH)均互为同系物关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
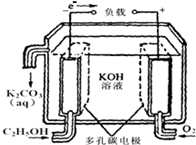 (1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);
(1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 | |
| C. | 向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与液溴混合后加入铁粉;光照甲烷与氯气的混合气体 | |
| C. | 苯与氢气在镍作催化剂的条件下反应;乙烯与水反应制乙醇 | |
| D. | 乙醇与乙酸的酯化反应;乙酸乙酯在酸性条件下的水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入一定量的CaCl2固体 | B. | 通入一定量的HCl气体 | ||
| C. | 加入10 mL0.5 mol/L的盐酸 | D. | 加入5 mL H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 某烷烃命名为3-甲基-5-乙基己烷一定是错误的 | |
| B. | 用溴的CCl4溶液可鉴别己烷、2,4-己二烯和甲苯 | |
| C. | 酸性条件下CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 1 mol八溴醚分子(结构如图)充分水解最多消耗8 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com