
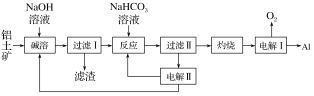
【题目】(1)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
①“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_______________。
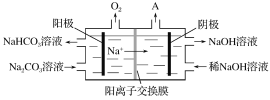
②“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为___________,阴极产生的物质A的化学式为________。
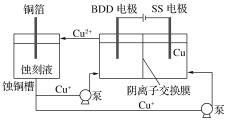
(2)与常规方法不同,有研究者用HCl—CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生,回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO·),请写出BDD电极上的电极反应________,进一步反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式__________。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
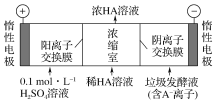
①阳极的电极反应式为____________。
②简述浓缩室中得到浓乳酸的原理:__________________
【答案】石墨电极被阳极上产生的O2氧化 4CO32-+2H2O-4e-=4HCO3-+O2↑ H2 OH--e-=HO· Cu++HO·+H+=Cu2++H2O 4OH--4e-=2H2O+O2↑ 阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;A-通过阴离子交换膜从阴极进入浓缩室,H++A-=HA,乳酸浓度增大
【解析】
(1)以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3、铝硅酸钠,碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,电解II为电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气,以此分析解答。
(2)由图示可知阳极生成HO,在阳极上发生H++Cu++OH=Cu2++H2O,Cl-通过阴离子交换膜移入阳极区可生成CuCl2蚀刻液;
(3)①电解池中阳极上氢氧根离子失电子生成氧气;②根据电解池中离子的移动方向分析解答。
(1)①“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极上生成氧气,石墨电极被阳极上产生的O2氧化,易消耗,故答案为:石墨电极被阳极上产生的O2氧化;
②“电解Ⅱ”是电解Na2CO3溶液,由图可知,阳极溶液中的阴离子即水中的OH-放电生成O2,2H2O-4e-=O2↑+4H+,H+与CO32-结合生成HCO3-,由图阳极区Na2CO3生成NaHCO3),总电极反应为4CO32-+2H2O-4e-═4HCO3-+O2↑,阴极上氢离子得到电子生成氢气,故答案为:4CO32-+2H2O-4e-═4HCO3-+O2↑;H2;
(2)由图示可知阳极生成HO,电极反应式为OH--e-=HO (或H2O-e-=HO+H+),在阳极上发生H++Cu++OH=Cu2++H2O,然后H++Cu++OH=Cu2++H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区可生成CuCl2蚀刻液,故答案为:OH--e-=HO (或H2O-e-=HO+H+);H++Cu++OH=Cu2++H2O
(3)①阳极上是阴离子(氢氧根离子)发生失电子的氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
②在电解池的阳极上是OH-放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即A-通过阴离子交换膜从阴极进入浓缩室,这样:H++A-═HA,乳酸浓度增大,故答案为:阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-═HA,乳酸浓度增大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
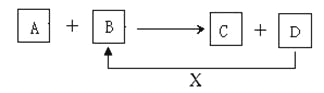
(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途______
(2)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式________________。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式________________________________________。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中常用二氧化锰和浓盐酸反应来制备氯气,实验装置如图所示。
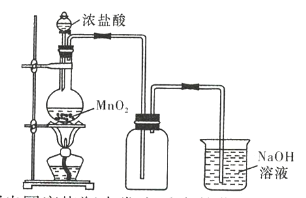
(1)写出圆底烧瓶中发生反应的化学方程式:___________________。
(2)若将过量的二氧化锰与20mL 12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,请写出两个可能的原因:①______________________________;②______________________________。
(3)为了提高浓盐酸的利用率,请写出两条改进措施:①______________________________;②______________________________。
(4)实验结束清洗仪器时,为了减小烧瓶中残留氯气对环境的污染,可以向烧瓶中加入 _____________ ,所发生反应的离子方程式 _________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C是实验室常用的三种气体发生装置,现有药品:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。欲利用这些药品制取NH3、Cl2、H2、CO2四种气体,试回答下列问题。
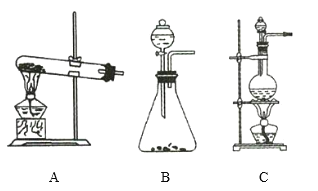
(1)①写出制取氨气的化学方程式: _____________________ ,氨气可用 _____________________ 进行干燥。
②制取![]() 的化学方程式为 _____________________ ,制取
的化学方程式为 _____________________ ,制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
(2)①制取![]() 应选用装置 _____________________ (填序号)。
应选用装置 _____________________ (填序号)。
②生成的氯气先通过盛有 _____________________ 的洗气瓶,除去 _____________________ 气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是 ( )
A.钠与水反应:Na +2H2O![]() Na++2OH– + H2↑
Na++2OH– + H2↑
B.将铜插入稀硝酸中:Cu+4H++2NO3–===Cu2++2NO2↑+H2O
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + ![]()
![]() BaSO4↓+H2O
BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种短周期元素的原子序数依次增大,其中仅有一种稀有气体元素。A和E最外层电子数相同,短周期主族元素的原子中,A 原子的半径最小,E元素焰色反应颜色为黄色;B、C、F和G在周期表中相邻,B、C同周期,F、G同周期C、F同主族, C元素是地壳中含量最多的元素;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y),D形成的分子为单原子分子。回答问题:
(1)G元素为______(填元素符号), Y的电子式为_______________。
(2)液态化合物Y与稀H2SO4酸化的K2Cr2O7溶液作用可产生一种无色助燃性气体及可溶性的Cr2(SO4)3,则该反应的离子方程式为______________________________________。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式____________,使用这种气球存在的隐患是________________。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式:_________________________,这两种盐均含有的化学键类型为________________________。
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X。写出该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2 FeO4在水中不稳定,发生反应:![]() +l0H2O
+l0H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
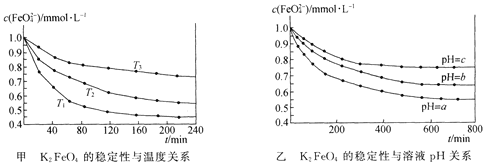
A.由图甲可知上述反应 △H < 0
B.由图甲可知温度:T1 > T2 > T3
C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱
D.由图乙可知图中a < c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2 和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法正确的是

A. 由图可知:乙酸的生成速率随温度升高而升高
B. 250-300℃时,温度升高而乙酸的生成速率降低的主要原因是因为催化剂的催化效率降低
C. 由300-400℃可得,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大。
D. 根据图像推测,工业上若用上述反应制备乙酸最适宜的温度应为400℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.一定条件下,合成氨反应中有0.5molN2发生反应,则反应中转移电子数为3NA
B.10克环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,则其中所含的氧原子数目为![]() NA
NA
C.12g石墨中含有3NA个C-C共价键
D.常温常压下有28g单晶硅晶体,则其中所含的Si﹣Si键数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com