
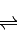 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-1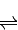 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1 SO3(g)+NO(g)的△H= kJ?mol-1.
SO3(g)+NO(g)的△H= kJ?mol-1.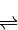 CH3OH(g).
CH3OH(g).
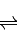 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-1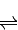 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1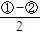 得到热化学方程式为:NO2(g)+SO2(g)
得到热化学方程式为:NO2(g)+SO2(g)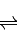 SO3(g)+NO(g)△H=-41.8KJ/mol;
SO3(g)+NO(g)△H=-41.8KJ/mol;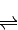 SO3(g)+NO(g)△H=-41.8KJ/mol;测得上述反应平衡时NO2与SO2体积比为1:6,依据化学平衡三段式列式计算,设二氧化氮消耗物质的量为x;
SO3(g)+NO(g)△H=-41.8KJ/mol;测得上述反应平衡时NO2与SO2体积比为1:6,依据化学平衡三段式列式计算,设二氧化氮消耗物质的量为x;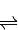 SO3(g)+NO(g)
SO3(g)+NO(g) 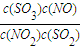 =
=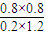 =2.7;
=2.7;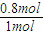 ×100%=80%
×100%=80%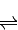 CH3OH(g)
CH3OH(g)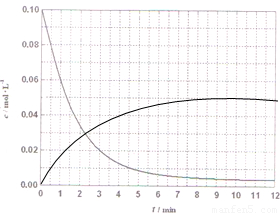 ;故答案为:
;故答案为: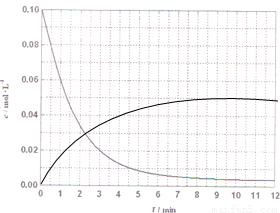 .
.

科目:高中化学 来源: 题型:
 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.| 催化剂 | △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
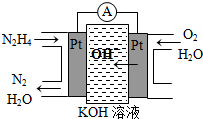 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
| 2 |
| 3 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 8 |
| 3 |
| 8 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
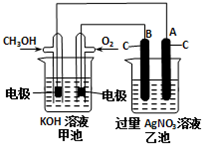 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 | 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com