
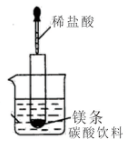
 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.分析 (1)如图所示的实验中,所试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量,碳酸在溶液中不稳定分解生成二氧化碳气体.
(2)①测反应热实验中所用的玻璃仪器除大、小烧杯,量筒、温度计、量热计;
②实验所测得的中和热△H=-$\frac{Q}{n}$,据此计算;
③A.实验装置保温、隔热效果差,热量散失,导致反应后的温度低;
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低;
C.量取HCl溶液的体积时仰视读数,导致放出的热量多;
D.误用了0.5mol•L-1NaOH则氢氧化钠量多,导致温度偏高.
解答 解:(1)①镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使溶液温度升高,分解,观察到冒气泡,
故答案为:镁片上有大量气泡,镁片逐渐溶解,烧杯中溶液产生气泡;
②镁与盐酸剧烈反应,产生氢气并放出大量的热,由于碳酸温度升高而分解生成二氧化碳气体;
故答案为:镁与盐酸反应产生H2,该反应为放热反应,受热碳酸分解生成二氧化碳气体;
③镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为Mg+2HCl═MgCl2+H2↑,
离子方程式为:Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
④当反应物的能量高于生成物的能量时,反应是放热反应,故镁条和盐酸的总能量大于MgCl2和H2的总能量,故答案为:大于;
(2)①实验中所用的玻璃仪器除大、小烧杯,量筒、温度计、量热计,故答案为:量热计;
②实验中测得放出的热量为1.138KJ,则所测得的中和热△H=-$\frac{Q}{n}$=-$\frac{1.138kJ}{0.05L×0.4mol/L}$=-56.9kJ/mol,故答案为:-56.9kJ/mol;
③A.实验装置保温、隔热效果差,热量散失,导致反应后的温度低,故错误;
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低,故错误;
C.量取HCl溶液的体积时仰视读数,导致放出的热量多,故正确;
D.误用了0.5mol•L-1NaOH则氢氧化钠量多,导致温度偏高,故正确;
故选CD.
点评 本题考查了化学反应现象和能量变化分析,注意分析通过化学变化放热而使溶液温度升高,掌握特征和基础是解决问题的关键.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| B. | 原电池工作时负极质量一定减少 | |
| C. | 红热的铁与水蒸气反应生成氧化铁和氢气 | |
| D. | 石油的分馏属于物理变化,煤的干馏属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═H++Na++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | NaHCO3═H++Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1HF 溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 加入CaCl2溶液后体系中的c(H+)不变 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4的溶解度增大,Ksp不变 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不变 | D. | BaSO4的溶解度不变,Ksp增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com