
| A. | NO | B. | CO | C. | 甲醛 | D. | SO2 |
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
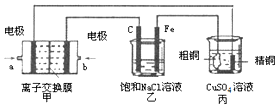
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
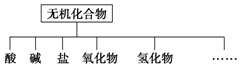 无机化合物可根据其组成和性质进行分类
无机化合物可根据其组成和性质进行分类| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | CO2和SiO2的熔沸点和硬度差异很大,是由于它们所含的化学键类型不同 | |
| C. | 某些金属与非金属原子间能形成共价键 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolAl3+离子含有的电子数为3NA | |
| B. | 7lgCl2约含有6.02×1023个筑原子 | |
| C. | 58.5g氯化钠固体中,含1 NA个阴离子 | |
| D. | 欲配制1.00L l.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
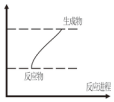
| A. | 灼热的炭与CO2的反应 | B. | 铝片与稀盐酸的反应 | ||
| C. | Ba(OH)2•8H2O和NH4Cl的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
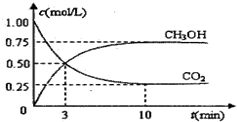
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com