
【题目】化合物E(二乙酸-1,4-环己二醇酯)是一种制作建筑材料的原料。其合成路线如下:

完成下列填空:
(1)A中含有的官能团是______;E的分子式是______;试剂a是______。
(2)写出反应类型:B→C______。
(3)C与D反应生成E的化学方程式:______。
(4)C的同分异构体,能使石蕊试剂显红色,写出该物质的一种结构简式______。
(5)设计一条以环己醇(![]() )为原料(其他无机试剂任取)合成A的合成路线。
)为原料(其他无机试剂任取)合成A的合成路线。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_____________________
目标产物)_____________________
【答案】碳碳双键,溴原子 C10H16O4 NaOH水溶液 取代反应  CH3(CH2)4COOH
CH3(CH2)4COOH 
【解析】
由题给有机物转化关系可知,在催化剂作用下,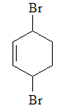 与氢气发生加成反应生成
与氢气发生加成反应生成 ,则B为
,则B为 ;
; 在氢氧化钠溶液中共热发生水解反应生成
在氢氧化钠溶液中共热发生水解反应生成![]() ,则C为
,则C为![]() ;在浓硫酸作用下,
;在浓硫酸作用下,![]() 与CH3COOH共热发生酯化反应生成
与CH3COOH共热发生酯化反应生成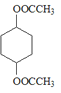 ,则D为CH3COOH。
,则D为CH3COOH。
(1)A中含有的官能团是碳碳双键、溴原子;E的分子式是C10H16O4;试剂a是NaOH水溶液,故答案为:碳碳双键、溴原子;C10H16O4;NaOH水溶液;
(2)B的结构简式为![]() ,
, 在氢氧化钠溶液中共热发生水解反应生成
在氢氧化钠溶液中共热发生水解反应生成![]() ,故答案为:水解反应或取代反应;
,故答案为:水解反应或取代反应;
(3)在浓硫酸作用下,![]() 与CH3COOH共热发生酯化反应生成
与CH3COOH共热发生酯化反应生成 ,反应的化学方程式为
,反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(4)C的结构简式为![]() ,C的同分异构体能使石蕊试剂显红色,说明分子中含有羧基,可为CH3(CH2)4COOH等,故答案为:CH3(CH2)4COOH等;
,C的同分异构体能使石蕊试剂显红色,说明分子中含有羧基,可为CH3(CH2)4COOH等,故答案为:CH3(CH2)4COOH等;
(5)以环己醇(![]() )为原料合成
)为原料合成 时,可先发生消去反应生成环己烯,然后发生加成反应邻二溴环己烷,在氢氧化钠醇溶液中邻二溴环己烷发生消去反应生成1,3—环己二烯,1,3—环己二烯与溴水发生1,4加成可生成目标物,合成路线为
时,可先发生消去反应生成环己烯,然后发生加成反应邻二溴环己烷,在氢氧化钠醇溶液中邻二溴环己烷发生消去反应生成1,3—环己二烯,1,3—环己二烯与溴水发生1,4加成可生成目标物,合成路线为,故答案为:
 。
。


科目:高中化学 来源: 题型:
【题目】某种激光染料,它由C、H、O三种元素组成,分子球棍模型如图所下列有关叙述正确的是
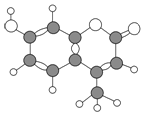
①分子式为C10H8O3 ②不溶于水 ③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色 ⑤1mol该物质最多能与含2 mol NaOH的溶液反应
A. ①②③④ B. ③④⑤ C. ②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是 ( )
A. 元素电负性越大的原子,吸引电子的能力越强
B. 在![]() 和
和![]() 中都存在配位键
中都存在配位键
C. SO2、SO3都是极性分子
D. 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。完成下列填空:
(1)上述烟气处理过程中涉及到的化学物质组成元素中,属于第三周期元素的是___;写出N的核外电子排布式___。
(2)已知SO2分子的空间构型为折线形,则SO2为___(选填“极性”、“非极性”)分子。
(3)将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时问后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42- | NO3- | OH- | Cl- |
浓度/(mol·L-1) | 5.5×10-3 | 8.5×10-4 | y | 2.0×10-4 | 3.4×10-3 |
①反应后溶液pH___7,表中y=___mol·L-1。
②写出NaClO2溶液吸收SO2的离子方程式___。
(4)烟气中的SO2还可采用氨法脱硫除去,其反应原理可用如图表示。
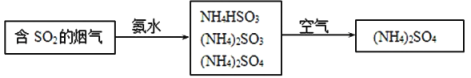
①写出SO2跟氨水反应生成NH4HSO3的化学方程式___。
②(NH4)2SO4溶液中浓度最大的离子是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:
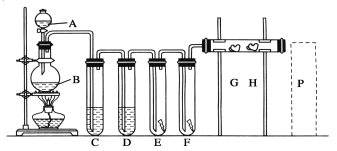
(1)B中所发生反应的离子方程式为___。
(2)洗气装置C中所放试剂为饱和食盐水,其作用是___,D中所放试剂为紫色石蕊试液,可观察到的现象为___,产生该现象的原因是氯气与水发生了反应,反应的离子方程式为___。
(3)E中为红色干布条,F中为红色湿布条,用以验证干燥的氯气是否具有漂白性,实验设计是否合理___(填“是”或“否”),若不合理应如何改进?(认为合理则此问不用做答)___。
(4)G是浸有淀粉KI溶液的棉花球,可观察到的现象是棉花球表面变成___,H是浸有NaBr溶液的棉花球,该处反应的化学方程式为___。
(5)P为尾气吸收装置,所需试剂为__(填化学式)溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738 kJ·mol-1, I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1, I4=10 540 kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式_________。
(2)比较BA2-和BA3的键角∠ABA的大小:BA2-____(填“>”“=”或“<”)BA3,请用价层电子对互斥理论解释:____________。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() 该同学所画的电子排布图违背了_______。
该同学所画的电子排布图违背了_______。
(4)E位于_____族_____区,价电子排布式为______。
(5)检验D元素的方法是______,请用原子结构的知识解释产生此现象的原因是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。

①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
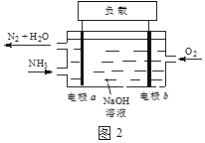
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A. 原子半径:Y>X B. 最高价氧化物的水化物的酸性:R>W
C. 气态氢化物的稳定性:X>W D. 单质与水(或酸)反应的剧烈程度:Z>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com