
分析 ClO2与H2O2反应生成NaClO2,Cl元素的化合价降低,则H2O2中O元素的化合价升高,则反应方程为:2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O;
将Cl2通入填充有固体NaClO2的反应柱内二者反应可制得ClO2,NaClO2中Cl从+3价升高到+4价,Cl2中Cl元素的化合价从0价降低到-1价,其反应为2NaClO2+Cl2═2ClO2+2NaCl;结合反应物之间的关系计算.
解答 解:ClO2与H2O2反应生成NaClO2,Cl元素的化合价降低,则H2O2中O元素的化合价升高,则反应方程为:2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O
(1)ClO2中O为-2价,则氯元素的化合价是+4价;Cl元素的化合价降低,被还原,则NaClO2作氧化剂,反应中生成1molNaClO2,转移电子物质的量为1mol;
故答案为:+4;氧化剂;1;
(2)由分析可知,反应的方程式为:2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O;
故答案为:2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O;
(3)将Cl2通入填充有固体NaClO2的反应柱内二者反应可制得ClO2,NaClO2中Cl从+3价升高到+4价,Cl2中Cl元素的化合价从0价降低到-1价,其反应为2NaClO2+Cl2═2ClO2+2NaCl,则还原产物为NaCl,当消耗标准状况下1.12L Cl2,即0.05mol,生成ClO2为0.1mol,其质量为0.1mol×67.5g/mol=6.75g;
故答案为:NaCl;6.75.
点评 本题以氯及其化合物的性质、氧化还原反应,把握习题中的信息及知识迁移应用为解答的关键,侧重氧化还原反应有关的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
 某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )
某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )| A. | 乙容器中使用了比甲容器更高的温度 | |
| B. | 乙容器中加入了某种不与体系反应的气体,增大了容器内的压强 | |
| C. | 乙容器中使用了催化剂 | |
| D. | 乙容器中可能既升高了温度又使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 配制250mL4.6mol/L的稀硫酸需取该浓硫酸62.5mL | |
| C. | 该硫酸浓度太大,不能用于干燥氨气 | |
| D. | 硫酸的摩尔质量为98g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ③④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,通入一段时间氮气,关闭活塞a | 无明显实验现象 |
| Ⅱ | 打开活塞b,滴加氯水,关闭活塞b | A中溶液变为红棕色. |
| Ⅲ | 打开活塞a,吹入氮气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| Ⅳ | 停止吹入氮气,关闭活塞a;打开活塞c,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
| Ⅴ | 打开活塞b,滴加氯水 | A中溶液变为红棕色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
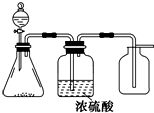 如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碱石灰和浓氨水 | B. | 锌和稀硫酸 | C. | 碳酸钙和稀盐酸 | D. | 铜和稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com