
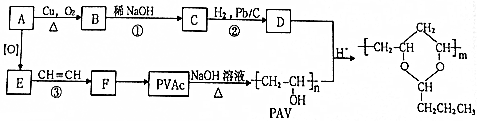

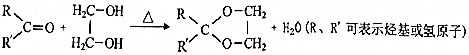
 ,该分子中最多有9个原子共平面;
,该分子中最多有9个原子共平面; $→_{△}^{NaOH}$
$→_{△}^{NaOH}$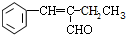 +H2O;
+H2O;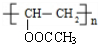 ;
;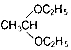 .
. 分析 A为饱和一元醇,通式为CnH2n+2O,其氧的质量分数约为34.8%,则有$\frac{16}{12n+2n+2+16}$×100%=34.8%,解得n=2,故A为CH3CH2OH,A氧化生成E为CH3COOH,E与乙炔发生加成反应生成F为CH3COOCH=CH2,F发生加聚反应得到PVAc为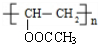 ,碱性水解得到PVA(
,碱性水解得到PVA( ).A在铜作催化剂的条件下氧化得到B为CH3CHO,B发生信息Ⅱ中的反应得到C为CH3CH=CHCHO,C发生还原反应生成D为CH3CH2CH2CHO,D与PVA发生信息Ⅲ中的反应得PVB.
).A在铜作催化剂的条件下氧化得到B为CH3CHO,B发生信息Ⅱ中的反应得到C为CH3CH=CHCHO,C发生还原反应生成D为CH3CH2CH2CHO,D与PVA发生信息Ⅲ中的反应得PVB.
(6)溴乙烷发生水解反应生成乙醇,乙醇发生催化氧化生成乙醛,乙醛与乙醇反应得到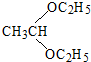 .
.
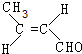
解答 解:(1)C为CH3CH=CHCHO,C中官能团的名称是碳碳双键和醛基,C的反式异构体的结构简式为 ,选择碳碳单键可以是碳碳双键平面与-CHO平面共面,可以使甲基中1个H原子处于平面内,该分子中最多有9个原子共平面,
,选择碳碳单键可以是碳碳双键平面与-CHO平面共面,可以使甲基中1个H原子处于平面内,该分子中最多有9个原子共平面,
故答案为:碳碳双键和醛基; ;9;
;9;
(2)D与苯甲醛反应的化学方程式为:CH3CH2CH2CHO+ $→_{△}^{NaOH}$
$→_{△}^{NaOH}$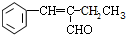 +H2O,
+H2O,
故答案为:CH3CH2CH2CHO+ $→_{△}^{NaOH}$
$→_{△}^{NaOH}$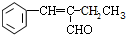 +H2O;
+H2O;
(3)反应③是CH3COOH与乙炔发生加成反应生成CH3COOCH=CH2,
故答案为:加成反应;
(4)PVAc的结构简式为: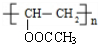 ,
,
故答案为: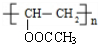 ;
;
(5)F为CH3COOCH=CH2,与F具有相同官能团的同分异构体的结构简式为:HCOOCH=CHCH3、HCOOCH2CH=CH2、CH3OOCCH=CH2、HCOOC(CH3)=CH2,
故答案为:HCOOCH=CHCH3、HCOOCH2CH=CH2、CH3OOCCH=CH2、HCOOC(CH3)=CH2;
(6)溴乙烷发生水解反应生成乙醇,乙醇发生催化氧化生成乙醛,乙醛与乙醇反应得到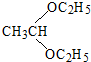 ,合成路线流程图为:CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{△}^{O_{2}/Cu}$CH3CHO$→_{△}^{CH_{3}CH_{2}OH}$
,合成路线流程图为:CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{△}^{O_{2}/Cu}$CH3CHO$→_{△}^{CH_{3}CH_{2}OH}$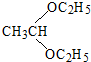 ,
,
故答案为:CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{△}^{O_{2}/Cu}$CH3CHO$→_{△}^{CH_{3}CH_{2}OH}$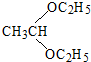 .
.
点评 本题考查有机物的推断与合成,关键是计算确定A的结构简式,再结合反应条件、PVA与PVB的结构简式进行推断,综合考查学生分析能力和综合运用化学知识的能力,注意把握有机物官能团的结构和性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基中含有电子数为10NA | |
| B. | 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA | |
| C. | 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA | |
| D. | 50mL12mol•L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

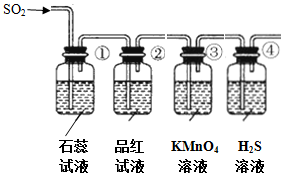
| 序号 | 实验现象 | 解释原因 |
| ① | 石蕊试液变红 | 石蕊试液变红说明SO2是酸性气体 |
| ② | 品红试液褪色 | SO2具有漂白性 |
| ③ | KMnO4溶液颜色褪色 | 反应的离子方程式5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+ |
| ④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
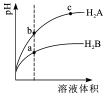 常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A. | H2A的酸性比H2B弱 | |
| B. | C点溶液的导电性比a、b点溶液的导电性都强 | |
| C. | 若0.1mol•L-1NaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(H+)>c(OH-) | |
| D. | N2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 MnO2是常见的氧化剂、催化剂和活性电极材料.
MnO2是常见的氧化剂、催化剂和活性电极材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X>W>Q | |
| B. | Q、X形成的化合物的电子式为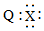 | |
| C. | 最简单氢化物的稳定性:Z>W | |
| D. | 工业上常用电解的方法制备X、Y的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
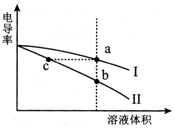 电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | I表示NaOH溶液加水稀释过程中溶液电导率的变化 | |
| B. | a、b、c三点溶液的pH:b>c>a | |
| C. | 将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | a点水电离出的n(H+)等于c点水电离出的n(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液中混有Ba(OH)2(CuSO4) | B. | Cu(NO3)2溶液中混有AgNO3(铜粉) | ||
| C. | CO2中混有CO(炽热的炭) | D. | CO2中混有HCl气体(NaOH溶液) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com