
| A.18gH218O分子中含有的10NA个质子 |
| B.将3mol NO2完全溶于水,生成NO气体,气体的物质的量变为2mol |
| C.将1.5molCO2气体通入到1L 1mol/L的NaOH溶液中,生成1mol碳酸钠 |
| D.2Cu2S+2H2SO4+5O2=4CuSO4+2H2O反应中,当1mol O2发生反应时,还原剂所失电子的物质的量 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.4L 0.5mol/L的NaCl溶液 | B.2L 0.8mol/L的NaOH溶液 |
| C.1L 1mol/L的Na2CO3溶液 | D.0.5L 1.2mol/L的Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
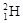 和
和 组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。
组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。 2-微粒的结构示意图: 。
2-微粒的结构示意图: 。 MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。
MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.⑤>④>③>②>① | B.②>①>③>④>⑤ |
| C.②>③>④>①>⑤ | D.①>②>③>④>⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用托盘天平称取10.6g Na2CO3固体 |
| B.将Na2CO3固体放入容量瓶中,加水至刻度线 |
| C.定容时俯视液面,所得溶液浓度偏低 |
| D.加水时不慎超过刻度线,用胶头滴管直接吸出多余液体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8 g甲烷含有的共价键数约为NA |
| B.常温常压下,22.4 L二氧化碳原子总数为3NA |
| C.1 mol Fe与足量稀HNO3反应,转移3 NA个电子 |
| D.3.2g硫(结构见图)含S-S键的数目为0.8NA |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3:2:2 | B.3:3:1 | C.1:3:3 | D.1:2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 的浓硫酸的体积为:__________mL(计算
的浓硫酸的体积为:__________mL(计算查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ×100% ②C=
×100% ②C= ③上述溶液中再加入VmL水后,所得溶液的质量分数大
③上述溶液中再加入VmL水后,所得溶液的质量分数大| A.②④ | B.②③ | C.①③ | D.①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com